
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| l键能/kJ•mol | 460 | 360 | 436 | 431 | 176 | 347 |
| A. | +412 kJ•mol-1 | B. | -412 kJ•mol-1 | C. | +236 kJ•mol-1 | D. | -236 kJ•mol-1 |
分析 由信息可知,△H=反应物的总键能-生成物的总键能,结合表格数据计算.
解答 解:由信息可知,△H=反应物的总键能-生成物的总键能,则SiCl4(g)+2H2(g) $\frac{\underline{\;高温\;}}{\;}$si(s)+4HCl(g),该反应的反应热AH为(360kJ/mol)×4+(436kJ/mol)×2-(176kJ/mol×2+431kJ/mol×4)=+236 kJ•mol-1,
故选C.
点评 本题考查反应热与焓变,为高频考点,把握键能与反应热的关系为解答的关键,侧重分析与计算能力的考查,注意Si中共价键的数目为2为解答的难点和易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 符号为${\;}_8^{18}O$的原子常用于文物年代的测定 | |
| B. | CO2分子比例模型: | |
| C. | H2O2的电子式: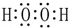 | |
| D. | 结构简式为CH2CH2的分子可发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应放出197 kJ 的热量 | |
| B. | 生成SO3为2 mol | |
| C. | SO2和SO3物质的量之和为2 mol | |
| D. | SO2的物质的量和SO3物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 伴随有能量变化的物质变化都是化学变化 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 | |
| C. | 已知相同条件下2SO2(g)+O2(g)?2SO3(g)△H1,反应2SO2(s)+O2(g)?2SO3(g)△H2,则△H1>△H2 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓H2SO4与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核内有8个中子的碳原子:$\stackrel{8}{6}$ C | B. | 氯离子的结构示意图: | ||
| C. | HCl的电子式: | D. | 甲烷分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2是还原剂 | B. | MnCl2是氧化产物 | C. | Cl2是氧化产物 | D. | H2O是还原产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com