
| A、已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c (Mg2+)?c (CO32-)=6.82×10-6 |
| B、常温下,在0.10 mol?L-1的NH3?H2O溶液中加入少量NH4Cl晶体,c( NH4+)/c(NH3?H2O)值变大 |
| C、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c (H2CO3) |
D、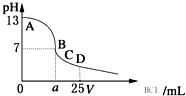 室温下,在25 mL 0.1 mol?L-1NaOH溶液中逐滴加入0.2 mol?L-1HCl溶液,pH与滴加HCl溶液体积的关系曲线如图所示. 室温下,在25 mL 0.1 mol?L-1NaOH溶液中逐滴加入0.2 mol?L-1HCl溶液,pH与滴加HCl溶液体积的关系曲线如图所示. |


科目:高中化学 来源: 题型:
| A、24g NaH中阴离子所含电子总数为NA |
| B、1mol苯分子中含有3NA个碳碳单键 |
| C、NO2和H2O反应毎生成2mol HNO3时转移的电子数目为2NA |
| D、在0.1mol/LK2CO3溶液中,阴离子数目大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质都是由同种元素组成的,只含一种元素的物质一定是纯净物 |
| B、金属铝排在金属活动性顺序表中氢元素的前面,铝与酸反应一定放出氢气 |
| C、中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应 |
| D、氧化物中都含有氧元素,含氧元素的化合物不一定是氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
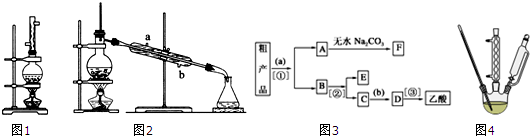
查看答案和解析>>
科目:高中化学 来源: 题型:
| ①足量稀硫酸 |
| ②过滤 |
| ③通入足量Cl2 |
| ④加热煮沸 |
| ⑤稀释至250mL |
| ⑥用0.4000mol?L-1 |
| 的KI溶液滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
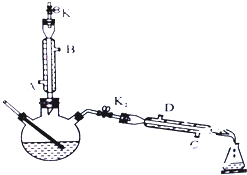 如图所示为制取乙酸乙酯的实验装置改进图,请回答下列问题
如图所示为制取乙酸乙酯的实验装置改进图,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
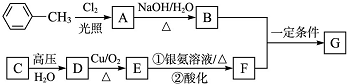
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X2ZY3 |
| B、X4Y2Z2 |
| C、X3YZ |
| D、X4ZY |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com