
【题目】气体的自动化检测中常常应用根据原电池原理设计的传感器。下图为电池的工作示意图,气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。
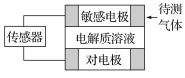
待测气体 | 部分电极反应产物 |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |
则下列说法中正确的是
A. 上述气体检测时,敏感电极均作电池负极
B. 检测Cl2气体时,敏感电极的电极反应式为Cl2+2e-===2Cl-
C. 检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-===4OH-
D. 检测Cl2和CO体积分数相同的两份空气样本时,传感器上电流大小、方向相同
科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:
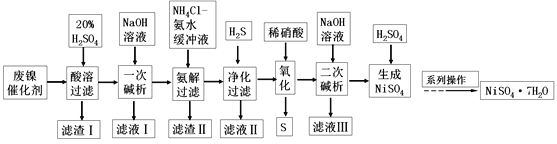
已知:①NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl-氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时为了提高浸取率,可采取的措施有________(任写出一条)。
(2)“滤渣I”的主要成分是_________。
(3)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为__________。
(4)“氨解”的目的为___,“净化”时加入的H2S的目的是将镍元素转化为____沉淀。
(5)“氧化”时发生反应的离子方程为________。
(6)“二次碱析”时,若使溶液中的Ni2+沉淀完全(离子浓度≤10-5mol·L-1时,离子沉淀完全),则需维持c(OH-)不低于_______(已知Ni(OH)2的Ksp=2×10-15,![]() ≈1.4)。
≈1.4)。
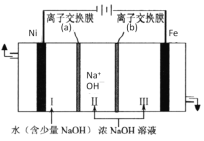
(7)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-。电解时阳极的电极反应式为________,离子交换膜(b)为__________(填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.1 mol·L-1 HA溶液中逐滴加入0.2 mol·L-1 MOH溶液,所得溶液的pH变化曲线如图所示。下列有关说法正确的是 ( )
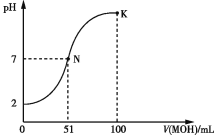
A.HA的电离方程式:HA![]() H++A-
H++A-
B.N点、K点水的电离程度:N<K
C.N点溶液中:c(A-)=c(M+)=c(H+)=c(OH-)
D.K点溶液中:c(OH-)+c(MOH)+c(A-)-c(H+)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图,下列判断中正确的是
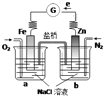
A.向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成
B.烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低
C.电子从Zn极流出,流入Fe极,经盐桥回到Zn极
D.烧杯b中发生反应为Zn-2e-=Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是
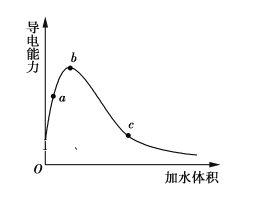
A.a、b、c三点溶液的pH:c<a<b
B.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
C.a、b、c三点CH3COOH的电离程度:c<a<b
D.a、b、c三点溶液用1 mol·L1 NaOH溶液中和,消耗NaOH溶液体积:c<a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的结构![]()
![]() 其中Ⅰ、Ⅱ为未知部分的结构
其中Ⅰ、Ⅱ为未知部分的结构![]() 下列是X发生反应的转化关系图及E的信息.
下列是X发生反应的转化关系图及E的信息.
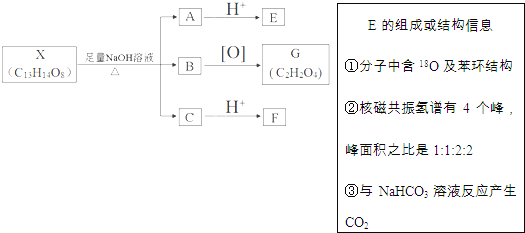
回答下列问题:
![]() 中官能团的名称为 ______ ,F不能发生和化学反应类型有 ______
中官能团的名称为 ______ ,F不能发生和化学反应类型有 ______
A.取代反应 ![]() 加成反应
加成反应 ![]() 氧化反应
氧化反应 ![]() 消去反应
消去反应
![]() 的分子式为 ______ B与G反应可生成高分子化合物M,其化学方程式是 ______
的分子式为 ______ B与G反应可生成高分子化合物M,其化学方程式是 ______
![]() 在足量NaOH溶液中反应的化学方程式为 ______
在足量NaOH溶液中反应的化学方程式为 ______
![]() 化合物E有多种同分异构体,满足下列条件的所有同分异构体有 ______ 种,任写其中一种的结构简式为 ______
化合物E有多种同分异构体,满足下列条件的所有同分异构体有 ______ 种,任写其中一种的结构简式为 ______
![]() 遇氯化铁溶液显紫色;
遇氯化铁溶液显紫色;![]() 分子中除苯环外物其中它环;
分子中除苯环外物其中它环;![]() 能发生眼镜反应.
能发生眼镜反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+![]() O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-280.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-290.0 kJ·mol-1
此反应的热化学方程式是_______。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
若用标准状况下22.4L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为_mol,放出的热量为___kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-540 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1molCH4还原NO2至N2,整个过程中放出的热量为860 kJ,则ΔH2=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图回答下列问题。
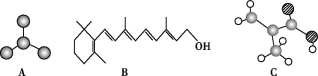
(1)图A是由4个碳原子结合成的某种烷烃(氢原子没有画出)。
①写出该有机物的系统命名法的名称:______。
②该有机物的同分异构体的核磁共振氢谱中应有___种峰。
(2)图B的键线式表示维生素A的分子结构。
①该分子的化学式为____。
②1 mol维生素A最多可与____mol H2发生加成反应。
(3)某物质只含C、H、O三种元素,其分子模型如图C所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。
①该物质的结构简式为_________。 ②该物质中所含官能团的名称为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种兴奋剂的结构简式如图所示。下列有关该物质的说法正确的是
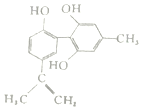
A.遇![]() 溶液显紫色,因为该物质与苯酚互为同系物
溶液显紫色,因为该物质与苯酚互为同系物
B.滴入酸性![]() 溶液观察到紫色褪去,说明分子结构中存在碳碳双键
溶液观察到紫色褪去,说明分子结构中存在碳碳双键
C.1mol该物质分别与浓溴水和![]() 反应时,最多消耗4mol
反应时,最多消耗4mol![]() 和
和![]()
D.该物质能与碳酸钠溶液发生反应产生二氧化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com