
【题目】(1)FeS2(二硫化亚铁)不溶于水,可溶于适量的稀硝酸中,离子反应式如下:
____ FeS2+ ____ H++ ____ NO3-= ____ Fe2++ ____ S↓+ ____ NO↑+ ____H2O
回答下列问题:配平此氧化还原反应方程式_____________________________________,还原剂为______________。
(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是_____(填字母)
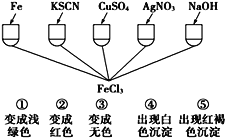
A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1L 0.2mol·L-1的FeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是________,此反应的离子方程式:________。
【答案】3、8、2、3、6、2、4 还原剂为FeS2 C Fe2+ 2Fe2++Cl2=2Fe3++2Cl-
【解析】
(1)FeS2中铁元素化合价+2价,硫元素化合价-1价,反应后硫元素化合价为0价,氮元素化合价+5价变化为+2价,结合原子守恒和电子守恒配平化学方程式,还原剂为元素化合价升高的物质;(2)①Fe与FeCl3溶液反应的离子方程式为:Fe + 2Fe3+= 3Fe2+;②KSCN与FeCl3溶液反应的离子方程式为:Fe3+ + 3SCN- = Fe(SCN)3;③硫酸铜与与FeCl3溶液不反应;④硝酸银与FeCl3溶液反应的离子方程式为:Cl-+ Ag+ =AgCl↓,产生白色沉淀,但不是Fe3+的性质;⑤氢氧化钠与FeCl3溶液反应的离子方程式为:Fe3+ + 3OH- = Fe(OH)3↓。
(3)还原性Fe2+>Br-,向FeBr2溶液中通入Cl2时,反应顺序为2Fe2++Cl2===2Fe3++2Cl-、2Br-+Cl2===Br2+2Cl-。
(1)FeS2中铁元素化合价+2价,硫元素化合价-1价,反应后硫元素化合价0价,氮元素化合价+5价变化为+2价,根据原子守恒和电子守恒配平离子方程式为:3FeS2+8H++2NO3-=3Fe2++6S↓+2NO↑+4H2O,还原剂为元素化合价升高的反应物,FeS2中硫元素化合价升高,所以FeS2是还原剂。
(2)①Fe与含Fe3+反应的离子方程式为:Fe + 2Fe3+= 3Fe2+,溶液由棕黄色变为浅绿色,正确;②KSCN与Fe3+反应的离子方程式为:Fe3+ + 3SCN- = Fe(SCN)3,溶液由棕黄色变为红色,正确;③硫酸铜与与FeCl3溶液不反应,溶液不会变为无色,错误;④硝酸银与Fe3+不能发生离子反应 ;⑤氢氧化钠与Fe3+反应的离子方程式为:Fe3+ + 3OH- = Fe(OH)3↓,出现红褐色沉淀,正确;故选C。
(3)还原性Fe2+>Br-,Fe2+先与Cl2反应,1L 0.2mol·L-1的FeBr2溶液中Fe2+的物质的量是0.2mol,根据2Fe2++Cl2===2Fe3++2Cl-,0.2mol Fe2+消耗氯气0.1mol,所以向1L 0.2mol·L-1的FeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是Fe2+,反应离子方程式是2Fe2++Cl2=2Fe3++2Cl-。


科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.根据要求回答相关问题:

(1)甲烷燃料电池的负极反应式______.
(2)石墨电极(C)的电极反应式为______.
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将______(填“增大”“减小”或“不变”).
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成标况下气体的的体积为______;丙装置中阴极析出铜的质量为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于含氯消毒剂的解释不正确的是
A. 室温下,氯气通入NaOH溶液中制得漂白液 Cl2+2OH-=Cl-+ClO-+H2O
B. 氯水具有杀菌消毒作用:Cl2+H2O=HCl+HClO
C. 氯水应避光保存的原因是:2HClO![]() H2O+Cl2↑
H2O+Cl2↑
D. 向Ca(ClO)2溶被中通入造量CO2可增强漂白效果:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.6g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质C(s)的燃烧热为Y kJ·mol-1,则1 mol C(s)与O2(g)反应生成CO(g)的反应热ΔH为( )
A. -Y kJ·mol-1 B. -(5X-0.5Y)kJ·mol-1
C. -(10X-Y)kJ·mol-1 D. +(10X-Y)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列计算结果正确是
A. 0.5L、8mol/L 浓盐酸与足量MnO2完全反应产生22.4L(标准状况下)Cl2
B. 2H2S+SO2=3S↓+2H2O反应中氧化产物与还原产物的物质的量之比为1:2
C. 将NO2和O2等体积混合充满一试管,倒置于水槽中,充分反应后,试管中剩余气体占试管容积的1/8
D. 标准状况下,用一充满HCl气体的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内盐酸的物质的量的浓度为(1/22.4)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先制得了氯气。如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。
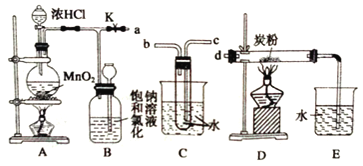
(1)A中圆底烧瓶内发生反应的离子方程式:_____________________________________。
(2)要将C装置接入B和D之间,正确的接法是a→_____→_____→d。
(3)实验开始先点燃A处的酒精灯,打开夹子K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为________________________。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是___________________________________。
(4)D处反应完毕后,关闭夹子K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是
A. 在透明溶液中:Cu2+、Mg2+、SO42-、Cl-
B. 加入铝粉产生H2的溶液中:Ba2+、Fe2+、HCO3-、NO3-
C. NaAlO2溶液中:Cu2+、Al3+、Cl-、CO32-
D. 常温下AG=lg![]() =12的溶液中:Na+、K+、S2O32-、SO42-
=12的溶液中:Na+、K+、S2O32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O![]()
![]() +OH
+OH
C. 由Na和C1形成离子键的过程:![]()
D. 电解精炼铜的阴极反应:Cu2+ +2e![]() Cu
Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com