
科目:高中化学 来源: 题型:
下列说法中正确的是
A.处于最低能量的原子叫做基态原子
B.原子由基态变为激发态要产生发射光谱
C.同一原子中,2p能级比3p能级的轨道数少
D.3d轨道能量小于4s
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ/mol。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
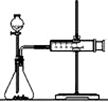
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L),设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快。 |
 (1)甲同学的实验目的是__________________________________________;要得出正确的实验结论,还需控制的主要实验条件是___________________________________。
(1)甲同学的实验目的是__________________________________________;要得出正确的实验结论,还需控制的主要实验条件是___________________________________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验。完成该实验应选用的实验药品是______________________
_____________;应该测定的实验数据是_____________________________。
实验二:某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:____________________________________________________________________;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:____________________________________________________________________。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片纯度、质量、表面积均相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中。
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化。
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验a中______________________,实验b中________________________,则说明
原因Ⅲ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,48gO3与O2混合气体中含氧原子数为3NA
B.1.8g的NH4+离子中含有的电子数为0.1NA
C.11.2L氧气中所含有的原子数为NA
D.标准状况下,22.4 LC6H14中所含碳原子数分子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
2014年1月4日,国家减灾办、民政部首次将危害健康的雾霾天气纳入2013年自然灾情进行通报。雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。
(1)用SO2气体可以消除汽车尾气中NO2, 已知NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
一定条件下,将NO2与SO2以体积比1∶2置于体积为1L 密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K= 。
(2)目前降低尾气中的NO和CO可行方法是在汽车排气管上安装催化转化器。NO和CO在催化转换器中发生反应:
2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-a kJ·mol-1。
N2(g)+2CO2(g) △H=-a kJ·mol-1。
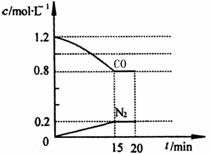 在25℃和101kPa下,将2.0mol NO、2.4mol气体
在25℃和101kPa下,将2.0mol NO、2.4mol气体
CO通入到固定容积为2L的容器中,反应过程中部分物
质的浓度变化如右图所示:
①有害气体NO的转化率为 ,0—15min
NO的平均速率v(NO)= mol/(L·min)。
②20min时,若改变反应条件,导致CO浓度减小,
则改变的条件可能是 (选填序号)。
 a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③如图所示,无摩擦、无质量的活塞1、2将反应器隔
成甲、乙两部分,在25℃和101kPa下实现平衡时,各部分
体积分别为V甲、V乙。此时若去掉活塞1,不引起活塞2的移
动。则x= ,V甲:V乙=
(3)消除汽车尾气中NO2也可以用CO,已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。写处消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案能达到目的的是( )
A.除去Fe粉中混有的I2:加热使I2升华
B.除去NaCl固体中混有的MgCl2:加入KOH溶液后过滤,滤液蒸发结晶
C.除去碳酸钠中混有的碳酸氢钠:加入过量的氢氧化钠溶液,蒸发结晶
D.除去氯气中含有的氯化氢气体:用饱和食盐水洗涤后干燥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com