
| A、②③⑥⑦⑧ |
| B、②④⑤⑥⑦ |
| C、①③②④⑦ |
| D、①③⑤⑦⑧ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
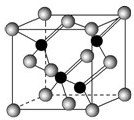 Ⅰ.2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如右图所示.试回答:
Ⅰ.2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如右图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、全部 | B、①②④ |
| C、①③⑤ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将压强减小至原来的一半 |
| B、将反应温度升高至900℃ |
| C、添加催化剂 |
| D、增大水蒸气的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨气通入水中能得NH3?H2O |
| B、四氯化碳萃取碘水中的碘 |
| C、过滤除去粗盐中的不溶性杂质 |
| D、蒸馏法将海水淡化为饮用水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将金属锂保存在石蜡中 |
| B、少量的白磷可保存在水中 |
| C、碱溶液用带磨口玻璃瓶塞的试剂瓶保存 |
| D、硝酸银溶液盛放在棕色试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在豆浆中加少量石膏,能使豆浆凝结为豆腐 |
| B、误服可溶性重金属盐,可立即服用牛奶或鸡蛋清 |
| C、温度越高,酶对某些化学反应的催化效率越高 |
| D、用灼烧的方法可鉴别毛织物和棉织物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2使溴水褪色:SO2+Br2+2H2O═SO42-+2Br-+4H+ | ||||||
| B、稀硫酸和Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | ||||||
C、NH4HCO3溶液与过量的NaOH溶液共热:NH
| ||||||
| D、Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com