
| A. | 1:4 | B. | 1:3 | C. | 1:2 | D. | 1:1 |
分析 令甲烷与氧气的质量分别为1g、4g,根据n=$\frac{m}{M}$计算甲烷、氧气的物质的量,同温同压下,二者体积之比等于物质的量之比,据此计算判断.
解答 解:甲烷与氧气的质量比为1:4,令甲烷与氧气的质量分别为1g、4g,则:
lg甲烷的物质的量为$\frac{1g}{16g/mol}$=$\frac{1}{16}$mol,
4g氧气的物质的量为$\frac{4g}{32g/mol}$=$\frac{1}{8}$mol.
同温同压下,甲烷与氧气的体积之比等于物质的量之比为$\frac{1}{16}$mol:$\frac{1}{8}$mol=1:2.
故选:C.
点评 本题考查阿伏伽德罗定律及推论的计算,难度不大,根据同温同压下,体积之比等于物质的量之比,判断气体的物质的量是解题关键.


科目:高中化学 来源: 题型:选择题
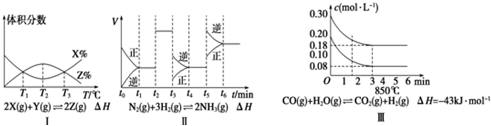
| A. | 由图I知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 由图II知,反应在t1时,NH3体积分数最大 | |
| C. | 由图II知,t3时采取的措施是降低反应体系温度 | |
| D. | III在10 L容器、850℃时反应,由图知,到4 min时,反应放出5.16 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类数相同 | |
| B. | 乙烷、苯、裂化汽油溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环已烷的密度都比水大 | |
| D. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 1.5 |
| 完全沉淀时 | 4.7 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ 2mol/L、Cu2+ 0.5mol/L | B. | Fe2+ 1mol/L、Fe3+ 1mol/L | ||
| C. | Fe2+ 0.5mol/L、Cu2+ 0.25mol/L | D. | Fe2+ 1.5mol/L、Cu2+ 0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知T、X、Y、Z、Q是中学化学常见的五种元素,其中T、X、Y、Z的信息如表.
已知T、X、Y、Z、Q是中学化学常见的五种元素,其中T、X、Y、Z的信息如表.| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com