
ʵ���ҳ����ڱ����������(KHC8H4O4)���ζ��������Ƶĵ�Ũ�ȣ���Ӧ���£�KHC8H4O4 + NaOH = KNaC8H4O4 + H2O�����������Ƶ���ҺŨ��Ϊ0. 1mol��L-1�������յ�ʱ����Һ��PHԼΪ9.1.
��1��Ϊ�궨����������Һ��Ũ��,Ӧѡ ����ָʾ�����ﵽ�ζ��յ�ʱ��Һ��
ɫ��Ϊ ɫ��
��2���ڲⶨ����������ҺŨ��ʱ,�����в���:������Һ�м���1-2��ָʾ�� ������ƿ�м�20-30ml����ˮ�ܽ� ��������������Һ�ζ����յ�,����Ӳ���ɫ���ظ����ϲ��� ��ȷ��ȡ0.4-0.5g�ڱ���������ؼ���250ml��ƿ�Т�������ʵ�����ݼ����������Ƶ����ʵ���Ũ�ȡ�
���ϸ�����,��ȷ��(�����)����˳����
��3������������,���ڱ����������ֱ�ӷŵ���ƿ���ܽ�,��ʵ���Ƿ���Ӱ��?
��˵������: 

��4���ζ�ǰ,������ˮϴ����ʽ�ζ���,Ȼ��Ӵ��ⶨ������������Һ�ζ�,�˲�����ʵ���� (�ƫ��ƫС������Ӱ�족)
��5����ȷ��ȡKHC8H4O4��������204.2������0.5105g������ˮ�����ָʾ������NaOH��Һ�ζ����յ㣬����NaOH 20 mL����NaOH��Һ��Ũ��Ϊ �����������λ��Ч���֣���
 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ѧ��ѡ��3���ʽṹ�����ʡ���15�֣�
(1) A��B����ȼ��ʱ���ų������ȣ�������ȼ�ϡ���֪A��BΪ������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��
| ������(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
����������Ϣ��д��B�Ļ�̬ԭ�Ӻ�������Ų�ʽ ��Ԥ��A����Ԫ���γɵļ��ӿռ乹��Ϊ ��
(2)��(Co)���γɷ���ʽ��ΪCo(NH3)5BrSO4����������������һ����������Һ�м���AgNO3��Һʱ������������������Һ�м�BaCl2��Һʱ����������ɫ��������������Ļ�ѧʽΪ ���������ӵ���λ��Ϊ ��
(3)�ο��±��е������۵�ش���������
| ���� | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| �۵�(��) | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
�����ϱ����ݽ����Ƶ�±���P��������Ȼ�����۵�仯���� ��
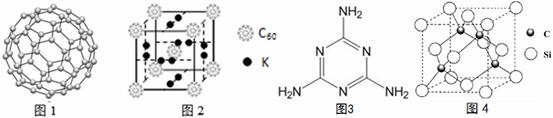
(4) C60������������ϡ�C60�Ľṹ��ͼ1����֪���ʯ�е�C-C�ļ���Ϊ154.45pm��C60��C-C����Ϊ145��140pm����ͬѧ�ݴ���ΪC60���۵���ڽ��ʯ������Ϊ�Ƿ���ȷ ������������ ����ѧ�Ұ�C60�ͼز�����һ��������һ�ָ���ϩ������侧����ͼ2��ʾ���������ڵ���ʱ��һ�ֳ����壬�����ʵ�Kԭ�Ӻ�C60���ӵĸ�����Ϊ ��
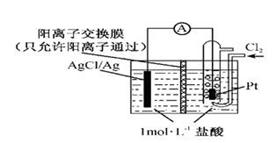
(5)�����谷���ӵĽṹ��ʽ��ͼ3�������е�ԭ�ӹ���ӻ������� ��l mol�����谷�����к� mol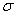 ����
����
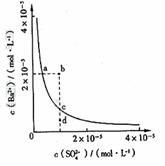
(6)̼����ľ�������ʯ�ľ���������ͼ4���辧���߳�Ϊa cm��̼ԭ��ֱ��Ϊb cm����ԭ��ֱ��Ϊc cm����þ����Ŀռ�������Ϊ ���ú�a��b��c��ʽ�ӱ�ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijԭ���װ����ͼ��ʾ������ܷ�ӦΪ:2Ag��Cl2��2AgCl������˵����ȷ����( )
 A��������ӦΪAgCl ��e�� ��Ag ��Cl
A��������ӦΪAgCl ��e�� ��Ag ��Cl ��
��
B���ŵ�ʱ������Ĥ�Ҳ���Һ���д�����ɫ��������
C������NaCl��Һ�������ᣬ�����ܷ�Ӧ��֮�ı�
D������·��ת��0.01 mol e��ʱ������Ĥ�����Һ��Լ
����0.02 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪������BaSO4��������233�����ܽ��Ϊ2.33��10��4g������KspΪ �� ��
A. 2.33��10��4 B. 1��10��5 C. 1��10��10  D. 1��10��12
D. 1��10��12
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�¶��£�BaSO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵����ȷ���� ��  ��
��
A. ����Na2SO4����ʹ��Һ��a��䵽b��
B. ͨ����������ʹ��Һ��d��䵽c��
C. d����BaSO4��������
D. a���Ӧ��Ksp����c���Ӧ��Ksp
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ȷ���ǣ���
| A�� | Na2O��Na2O2���ܺ�ˮ��Ӧ���ɼ�����Ǽ��������� | |
| B�� | Na2CO3��Һ��NaHCO3��Һ���ܸ�CaCl2��Һ��Ӧ�õ���ɫ���� | |
| C�� | Na2O2Ӧ�������ܷ⡢������������Ĺ��ƿ�� | |
| D�� | Na2O2��������������Na2O���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ��ij��ȤС����ݿα�ʵ����Ƶ�һ����˵��̼������̼���������ȶ��Ե���ʵ�飮��۲���ͼʵ��װ�á�����ʵ��ԭ�������ж�����˵�������������в���ѧ���ǣ���
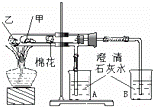
| A�� | ��ΪС�մ���Ϊ���� | |
| B�� | ����ʵ�������û�з���A�ձ��ij���ʯ��ˮ����� | |
| C�� | ���Ȳ��þ��ܿ���A�ձ��ij���ʯ��ˮ����� | |
| D�� | Ҫ֤��̼�����������ܲ���ˮ������С�Թ�������մ����ˮ����ͭ��ĩ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪����Ԫ�ص�ԭ�Ӱ뾶��
| Ԫ�� | N | S | O | Si |
| ԭ�Ӱ뾶/1010 m | 0.75 | 1.02 | 0.74 | 1.17 |
�����������ݣ���Ԫ�ص�ԭ�Ӱ뾶������( )
A��0.80��10��10 m B��1.10��10��10 m
C��1.20��10��10 m D��0.70��10��10 m
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ũ������H3AsO3��SnCl2��Ӧ�����ӷ���ʽΪ�� 3SnCl2+12Cl��+2H3AsO3+6H+=2As
+3SnCl62��+6M�����ڸ÷�Ӧ��˵������ȷ������� �� ��
�� ��������H3AsO3���� ��ԭ�ԣ�Cl����As���� ÿ����7.5gAs����ԭ��ʧȥ�ĵ���Ϊ0.3mol���� MΪOH������ SnCl62�����������
A���٢ڢܢ� B���٢ۢ� C���٢ڢۢ� D��ֻ�Т٢�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com