
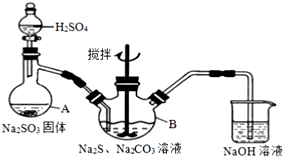
 硫代硫酸钠(Na2S2O3)是一种重要的化工产品.某兴趣小组在查阅资料后制备Na2S2O3,结合其性质进行了实验探究.
硫代硫酸钠(Na2S2O3)是一种重要的化工产品.某兴趣小组在查阅资料后制备Na2S2O3,结合其性质进行了实验探究.分析 (1)根据装置图可知仪器名称;
(2)仪器B中为硫酸钠、碳酸钠及二氧化硫反应生成硫代硫酸钠,根据硫原子的利用率为100%,且有无色无味气体生成应为二氧化碳,根据元素守恒可书写化学方程式;
(3)将生成硫代硫酸钠的混合溶液经过蒸发、结晶、过滤、洗涤、干燥可得粗产品;
(4)①单质碘具有氧化性,能氧化腐蚀橡胶;
②淀粉遇到单质碘变蓝色,根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
③求出硫代硫酸钠的质量,样品中硫代硫酸钠纯度=$\frac{m(Na{\;}_{2}S{\;}_{2}O{\;}_{3})}{m(样品)}$×100%.
解答 解:(1)根据装置图可知仪器A的名称为蒸馏烧瓶,
故答案为:蒸馏烧瓶;
(2)仪器B中为硫酸钠、碳酸钠及二氧化硫反应生成硫代硫酸钠,根据硫原子的利用率为100%,且有无色无味气体生成应为二氧化碳,所以发生反应的总反应方程式是4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2,
故答案为:4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2;
(3)将生成硫代硫酸钠的混合溶液经过蒸发、结晶、过滤、洗涤、干燥可得粗产品,
故答案为:洗涤;
(4)①单质碘具有氧化性,能氧化腐蚀橡胶,需要选取酸式滴定管,故选a;
②淀粉遇到单质碘变蓝色,所以滴定终点的现象为溶液刚好出现蓝色,且半分钟不褪去;
故答案为:溶液刚好出现蓝色,且半分钟不褪去;
③根据I2+2Na2S2O3=Na2S4O6+2NaI,n(I2)=amol/L×b×10-3L,知消耗的Na2S2O3的物质的量=2n(I2)=2amol/L×b×10-3L,根据现称取Wg硫代硫酸钠固体样品配成250mL的溶液,取25.00mL置于锥形瓶中,则被滴定的硫代硫酸钠质量为$\frac{1}{10}$Wg,故样品中硫代硫酸钠纯度的表达式为$\frac{2amol/L×b×10{\;}^{-3}L×158g/mol}{\frac{1}{10}wg}$×100%=$\frac{3.16ab}{w}$×100%;
故答案为:$\frac{3.16ab}{w}$×100%.
点评 本题考查了物质百分含量的探究,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 414 | 436 | 326.8 | 1032 | 464 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小、减小、增大 | B. | 减小、增大、增大 | C. | 增大、减小、减小 | D. | 减小、增大、减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去混在NO2中的NO:将气体与足量O2混合 | |
| B. | 除去混在CO2中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸 | |
| C. | 除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤 | |
| D. | 除去乙酸中混有的乙醇:加入金属钠后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
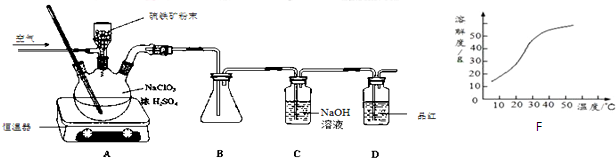
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
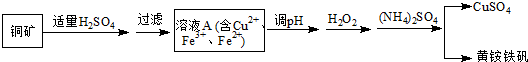
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn电极上发生的反应为:2H++2e-═H2↑ | |
| B. | H+向Zn电极移动 | |
| C. | 溶液的c(H+)减小 | |
| D. | 电子由Cu转移到Zn |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com