
| ① |
| ② |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
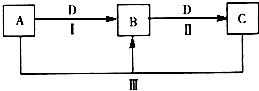 A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化关系如图所示(部分产物已略去).
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化关系如图所示(部分产物已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
 容积均为500 mL的Ⅰ,Ⅱ,Ⅲ三个密闭容器(容器体积恒定不变)中分别充入1 mol N2和2.5 mol H2,三个容器的反应温度分别为T1,T2,T3且恒定不变,在其他条件相同的情况下发生反应:N2+3H2?2NH3(△H<0).实验测得反应均进行到t min时N2的体积分数如图所示.下列说法正确的是( )
容积均为500 mL的Ⅰ,Ⅱ,Ⅲ三个密闭容器(容器体积恒定不变)中分别充入1 mol N2和2.5 mol H2,三个容器的反应温度分别为T1,T2,T3且恒定不变,在其他条件相同的情况下发生反应:N2+3H2?2NH3(△H<0).实验测得反应均进行到t min时N2的体积分数如图所示.下列说法正确的是( )| A、当v(H2)=3v(N2)时,可以说明三个容器中的反应达平衡状态 |
| B、在t min时,一定达化学平衡状态的是Ⅱ和Ⅲ |
| C、在t min时测得c(N2)Ⅲ=1 mol/L,若再向Ⅲ中充入1.5 mol N2和1 mol NH3,H2的转化率不变 |
| D、三个容器中的反应均达到平衡后,容器I中混合气体的平均相对分子质量最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、腌制腊类物质添加大量亚硝酸钠 |
| B、金针菇可用福尔马林浸泡来达到保鲜的目的 |
| C、用NaHCO3发酵面包 |
| D、竹笋用二氧化硫气体漂白 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com