
| c(CH3COO-) |
| c(Na+) |
| A、只有①② | B、只有②⑤ |
| C、只有②④⑤ | D、只有①⑤ |


科目:高中化学 来源: 题型:
| A、原子序数:X<Y<Z |
| B、气态氢化物稳定性:XH3<YH3<ZH3 |
| C、元素的非金属性强弱:X>Y>Z |
| D、电子层数:X<Y<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.0mol/L |
| B、1.5 mol/L |
| C、0.18 mol/L |
| D、0.24mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
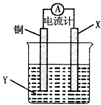 根据反应为 2Cu+O2+CO2+H2O=Cu2(OH)2CO3,设计如图所示原电池,下列说法错误的是( )
根据反应为 2Cu+O2+CO2+H2O=Cu2(OH)2CO3,设计如图所示原电池,下列说法错误的是( )| A、X可以是银或石墨 |
| B、电子从铜电极经外电路流向X电极 |
| C、Y是硫酸铜溶液 |
| D、X极上的电极反应式为 O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
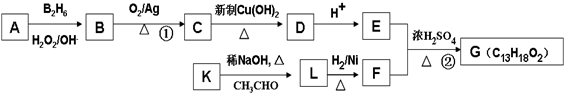

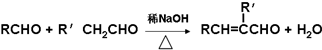
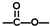 ”结构的共有
”结构的共有查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com