
分析 由结构可知分子式,分子中含碳碳双键、-OH,结合烯烃、醇的性质来解答.
解答 解:(1)烯丙醇的分子式为C3H6O;烯丙醇中除碳碳双键外还含有官能团的是羟基,故答案为:C3H6O;羟基;
(2)只有-OH与Na反应,0.3mol 烯丙醇与足量金属钠反应,能生成标准状况下的氢气为0.15mol×22.4L/mol=3.36L,故答案为:3.36;
(3)烯丙醇与溴水反应的化学方程式为CH2=CH-CH2OH+Br2→CH2BrCHBrCH2OH,故答案为:CH2=CH-CH2OH+Br2→CH2BrCHBrCH2OH;
(4)烯丙醇与CH3COOH发生酯化反应的化学方程式为CH2=CH-CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH=CH2+H2O,
故答案为:CH2=CH-CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH=CH2+H2O.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机反应方程式的书写,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 (1)将粉末形状大小相同的铁和铝分别与等浓度的稀盐酸反应产生气泡的速率铝>铁(填“<、>、=”).Al与盐酸反应的离子方程式是2Al+6H+=2Al3++3H2↑.
(1)将粉末形状大小相同的铁和铝分别与等浓度的稀盐酸反应产生气泡的速率铝>铁(填“<、>、=”).Al与盐酸反应的离子方程式是2Al+6H+=2Al3++3H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的质量不再改变 | |
| B. | 混合气的密度不再随时间而变化 | |
| C. | 容器内的压强不随时间而变化 | |
| D. | 单位时间内生成2a mol B,同时生成a mol C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
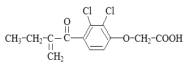 .下列有关利尿酸的说法中正确的是( )
.下列有关利尿酸的说法中正确的是( )| A. | 分子式是C13H14O4Cl2 | |
| B. | 1mol利尿酸最多能与5mol H2发生加成反应 | |
| C. | 一定条件下能发生加聚、缩聚反应 | |
| D. | 分子内处于同一平面内的原子不超过10个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气的水溶液可以导电,说明氯气是电解质 | |
| B. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| C. | 氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气 | |
| D. | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,说明BaCl2溶液具有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
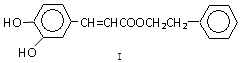

 或
或 (写1种);由Ⅳ生成Ⅱ的反应条件为NaOH醇溶液、加热.
(写1种);由Ⅳ生成Ⅱ的反应条件为NaOH醇溶液、加热.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
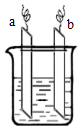 如图中ab相连后,两电极上发生的电极反应分别为:
如图中ab相连后,两电极上发生的电极反应分别为:| A. | a极材料一定为金属银 | |
| B. | b极为负极 | |
| C. | 装置中电解质溶液一定含有Ag+ | |
| D. | 装置中发生的反应方程式一定是Zn+2Ag+=Zn2++2Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO中有少量的NO2:用水洗涤后再干燥 | |
| B. | 食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干 | |
| C. | O2中有少量的CO:通过灼热的氧化铜 | |
| D. | NO2中有少量NH3:用水洗涤后干燥 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com