
����Ŀ������֪��Na2S2O3+H2SO4==Na2SO4+SO2��+S��+H2O��ijͬѧ̽��Ӱ�������������ϡ���ᷴӦ���ʵ�����ʱ�����������ϵ��ʵ�飺
ʵ����� | ��Ӧ�¶� | Na2S2O3Ũ��[ | ϡ���� | H2O | ||
V/mL | c/��mol/L�� | V/mL | c/��mol/L�� | V/mL | ||
�� | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
�� | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
�� | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
��1����ʵ��١��ڿ�̽�� �Է�Ӧ���ʵ�Ӱ�죬���V1��V2��V3�ֱ��� �� �� ��
��2��ʵ��١��ۿ�̽�� �Է�Ӧ���ʵ�Ӱ�죬���V4��V5�ֱ��� �� ��
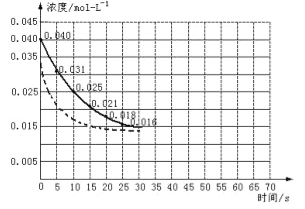
���������ڼ����������ܹ��ֽ��һ���������������÷�Ӧ���е�45��ʱ���ﵽƽ����NO2Ũ��ԼΪ0.0125mol/L������ͼ�е����߱�ʾ���������ֽⷴӦ��ǰ25���ڵķ�Ӧ���̡�

��3��ǰ20����������ƽ���������� mol/��L��s��
��4����ij�¶��´ﵽƽ��ʱ��ƽ�ⳣ������ʽ�� ��
��5����ij�¶��´ﵽƽ����ı���������������������ټ���������NO2��ƽ���ƶ��ķ����� ��NO2��ƽ��ת���� 68.75%�����������������������NO������ٷֺ��� �����������С�����䡱����
��6�����ڷ�Ӧ��ʼʱ�����������������������������Ӧ����20��ﵽƽ�⣬����ͼ�������������Ӵ�����Ӧ0��70s�����ߡ�
���𰸡�����1���¶ȣ�10.0��10.0��0��4����
��2��Ũ�ȣ�10.0��6.0 ��3����
����3��5.5��10��4��2����
��4��![]() ��2����
��2����
��5������Ӧ��������С��3����
��6��ͼʾ��1����
��������
�������������1���ɱ����������ݿ�֪��ʵ��١����¶Ȳ�ͬ��ʵ��١�������̽���¶ȶԷ�Ӧ����Ӱ�죬��V1=10.0mL�� V2=10.0mL�� V3=0mL��
��2��ʵ��١����¶���ͬ����ȡϡ��������ͬ����ʵ��١�������̽��c��H+���Է�Ӧ����Ӱ�죬��V4=10.0mL��V5=6.0mL��
����3����ͼ��֪��20����NO2��Ũ�ȱ仯Ϊ0.04mol/L��0.018mol/L=0.022mol/L����v��NO2��=![]() =0.0011mol/��Ls��������2NO2
=0.0011mol/��Ls��������2NO2![]() 2NO+O2������֮�ȵ��ڻ�ѧ������֮�ȣ�����v��O2��=
2NO+O2������֮�ȵ��ڻ�ѧ������֮�ȣ�����v��O2��=![]() v��NO2��=
v��NO2��=![]() ��0.0011mol/��Ls��=5.5��10-4mol/��Ls����
��0.0011mol/��Ls��=5.5��10-4mol/��Ls����
��4����ѧƽ�ⳣ������ָ��һ���¶��£����淴Ӧ�ﵽƽ��ʱ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ�����ڿ��淴Ӧ2NO2![]() 2NO+O2��ƽ�ⳣ��K=
2NO+O2��ƽ�ⳣ��K=![]() ��
��
��5��ij�¶��£���Ӧ2NO2![]() 2NO+O2�ڴﵽƽ��ı������������ټ���������NO2��Ϊ���ӷ�Ӧ��Ũ�ȣ�ƽ�������ƶ���ԭƽ��NO2��ƽ��ת����Ϊ68.75%�������������NO2���൱������ѹǿ��ƽ���൱����ԭ���Ļ����������ƶ���ת������С����ת����С��68.75%����Ӧ�����ӵ������࣬��NO������ٷֺ�����С��
2NO+O2�ڴﵽƽ��ı������������ټ���������NO2��Ϊ���ӷ�Ӧ��Ũ�ȣ�ƽ�������ƶ���ԭƽ��NO2��ƽ��ת����Ϊ68.75%�������������NO2���൱������ѹǿ��ƽ���൱����ԭ���Ļ����������ƶ���ת������С����ת����С��68.75%����Ӧ�����ӵ������࣬��NO������ٷֺ�����С��
��6�����ڷ�Ӧ��ʼʱ�����������������������������Ӧ���ʼӿ죬��ͬʱ����NO2Ũ�ȱ仯��������ƽ��ʱ�����̣�����Ӱ��ƽ���ƶ����ﵽƽ����NO2Ũ��ԼΪ0.0125mol/L���ݴ����������Ӵ�����ķ�Ӧ��������Ϊ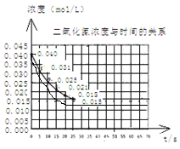 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л��������˵����ȷ����
A. ʯ���ѽ�͵�����ˮ�ⶼ���ɸ߷��ӻ���������С�������ʵĹ���
B. ��ϩ�ֱ�ʹ��ˮ������KMnO4��Һ��ɫ����Ӧԭ����ͬ
C. C6H14��5��ͬ���칹��
D. CH4��Cl2�������1:3��Ͽ��Ƶô�����CHCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʢٹ��˺����Ȼˮ �ڱ���ǵ�ʯ��ˮ ��ʯ����Һ ��ţ�� ������ ��ƣ�����������Һ���ǣ� ��
A.�٢�
B.�ڢ�
C.�ۢݢ�
D.�٢ۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҽ���ϣ�θ���������θ����IJ��˿ɷ��õ�ҩ���ǣ� ��
A. NaHCO3 B. Na2CO3 C. Al(OH)3 D. NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������HCl��Һ����Һ��������Ŀ����ٵ��ǣ� ��
A.CO32��
B.Al3+
C.SO42��
D.NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����У�û������ʵ���������
A. ��Fe(NO3)2��Һ�еμ�ϡ���� B. ��HClͨ��NaAlO2��Һ��
C. ��������SO2��Ʒ����Һ D. ��̼��������Һ�еμ�����������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��Ŀ���ܹ�ʵ�ֵ���( )
A. ��������ƽ��ȡ3.23 g NaCl���� B. �ý�ͷ�ι�ȡԼ1 mL��Һ
C. ��С�Թ��м���100 mLϡ���� D. ��50 mL��Ͳ��ȡ30.12 mLˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O5��һ����������������һ���¶��¿ɷ������·�Ӧ��2N2O5(g)![]() 4NO2(g)+O2(g) ��H��0��T1�¶�ʱ�����ܱ�������ͨ��N2O5���壬����ʵ�����ݼ��±���
4NO2(g)+O2(g) ��H��0��T1�¶�ʱ�����ܱ�������ͨ��N2O5���壬����ʵ�����ݼ��±���
ʱ��/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/��mol��L��1�� | 5.00 | 3.52 | 2.50 | 2.50 |
����˵����ȷ����
A. 500s��O2��ƽ����������Ϊ7.4��l0��4mol��L��1��s��1
B. T1�¶��¸÷�Ӧ�ﵽƽ��ʱ��ƽ��������NO2���������Ϊ50%
C. �ﵽƽ��������������䣬���������ѹ����ԭ����1/2����c(N2O5)��5.00mol��L��1
D. T1�¶��µ�ƽ�ⳣ��ΪK1��T2�¶��µ�ƽ�ⳣ��ΪK2����K1��K2����T1��T2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ�飺����ȥ����ֲ�����е�ˮ�����յ��CCl4��Һ�е�CCl4����ʳ�þƾ������в�ҩ��ȡ���е���Ч�ɷ֡��������ϻ��Һ����ȷ����������
A. ��Һ����ȡ������ B. ��ȡ������Һ
C. ��Һ��������ȡ D. ������ȡ����Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com