
| A. | 金属元素原子最外层电子数越少,该金属失电子能力越强 | |
| B. | 若存在简单阴离子R2-,则R一定位于ⅥA族 | |
| C. | aA2+、bB+、cC3-三种离子具有相同的电子层结构,则原子序数c>a>b | |
| D. | 铅位于周期表中金属和非金属的交界处,可作半导体材料 |
分析 A.金属性强弱与失去电子难易有关,与最外层电子数多少无关;
B.存在简单阴离子R2-,则R原子最外层电子数一定为6;
C.短周期元素的离子:aA2+、bB+、cC3-都具有相同的电子层结构,所以有:a-2=b-1=c+3,且A、B在周期表中C的下一周期,原子序数:a>b>c;
D.铅不位于周期表中金属和非金属的交界处,属于典型的金属元素.
解答 解:A.金属性强弱与失去电子难易有关,与最外层电子数多少无关,如Al原子最外层电子数比Na原子多,但Na的金属性强,失去电子的能力强,故A错误;
B.存在简单阴离子R2-,则R原子最外层电子数一定为6,一定位于ⅥA族,故B正确;
C.aA2+、bB+、cC3-都具有相同的电子层结构,所以有:a-2=b-1=c+3,所以原子序数:a>b>c,故C错误;
D.铅不位于周期表中金属和非金属的交界处,属于典型的金属元素,不能作半导体材料,故D错误;
故选B.
点评 本题考查元素周期表与周期律的综合运用,难度不大,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA | |
| C. | 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| D. | 分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:
科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
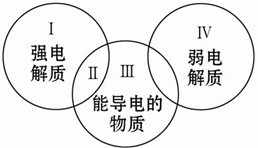 对下列物质:①镁 ②石墨 ③熔融氯化钠 ④盐酸 ⑤稀硫酸 ⑥氨水 ⑦白磷 ⑧硫酸钡 ⑨冰醋酸 ⑩二氧化碳,分类正确的是( )
对下列物质:①镁 ②石墨 ③熔融氯化钠 ④盐酸 ⑤稀硫酸 ⑥氨水 ⑦白磷 ⑧硫酸钡 ⑨冰醋酸 ⑩二氧化碳,分类正确的是( )| A. | Ⅰ包含的物质有③④⑤⑧ | B. | Ⅱ中包含的物质是③ | ||
| C. | Ⅲ中包含的物质是①②③⑤⑥⑧ | D. | Ⅳ中包含的物质是⑥⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 或
或 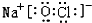 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B元素不一定都是短周期元素 | |
| B. | A和B元素一定是同一主族元素 | |
| C. | A和B元素一定都是非金属元素 | |
| D. | A、B可以相互化合形成化合物BA2或B2A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用合适的催化剂可以加快反应的速率 | |
| B. | 升高温度可以加快反应速率 | |
| C. | 减小压强能加快反应速率 | |
| D. | 增大N2浓度可以加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝能产生铝热反应 | B. | 铝的化学性质不活泼 | ||
| C. | 常温下铝不能与氧气反应 | D. | 铝表面能形成致密的氧化膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com