
���� ��1���÷�Ӧ��FeԪ�ػ��ϼ���+2�۱�Ϊ+6�ۡ�OԪ�ػ��ϼ���-1�۱�Ϊ0�ۣ��õ��ӻ��ϼ۽��͵ķ�Ӧ������������ʧ���ӻ��ϼ����ߵķ�Ӧ���ǻ�ԭ�����ٽ��Na2FeO4��ת�Ƶ���֮��Ĺ�ϵʽ���㣻
��2��ʪ���Ʊ�������أ�K2FeO4��ʱ��Fe��OH��3ʧ���ӱ���������K2FeO4����C1O-������������ԭ����C1-���������������ڼ��������´��ڣ����Ը÷�Ӧ���ڼ��������½��У��ٽ��ת�Ƶ����غ���ƽ����ʽ��
��� �⣺��1���÷�Ӧ��FeԪ�ػ��ϼ���+2�۱�Ϊ+6�ۡ�OԪ�ػ��ϼ���-1�۱�Ϊ0�ۣ�ʧ���ӱ���������Ӧ��������ΪO2��Na2FeO4������Na2FeO4��ת�Ƶ���֮��Ĺ�ϵʽ֪��ÿ����l mol Na2FeO4ת�Ƶ��ӵ����ʵ���Ϊ4mol+1mol=5mol��
�ʴ�Ϊ��O2��Na2FeO4��5��
��2��ʪ���Ʊ�������أ�K2FeO4��ʱ��Fe��OH��3ʧ���ӱ���������K2FeO4����ClO-������������ԭ����Cl-���������������ڼ��������´��ڣ����Ը÷�Ӧ���ڼ��������½��У������ӷ�ӦΪ2Fe��OH��3+3ClO-+4OH-�T2FeO42-+3Cl-+5H2O��
�ʴ�Ϊ��2Fe��OH��3+3ClO-+4OH-�T2FeO42-+3Cl-+5H2O��
���� ���⿼��������ԭ��Ӧ�����㣬Ϊ��Ƶ���㣬���շ�Ӧ��Ԫ�صĻ��ϼ۱仯Ϊ���Ĺؼ������ط�����Ӧ�á����������Ŀ��飬ע�⣨1����OԪ�صĻ��ϼ۱仯����Ŀ�ѶȲ���


 �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д� ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | Mg2+ | Cr3+ | Cl- |
| Ũ�ȣ�mol/L�� | 0.5 | 0.01 | a |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

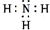 �����еĻ�ѧ�������Ǽ��Թ��ۼ�
�����еĻ�ѧ�������Ǽ��Թ��ۼ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������Һ�еμӹ���Ũ��ˮ��Al3++4OH-�TAlO2-+2H2O | |
| B�� | NaHCO3��Һˮ�⣺HCO3-+H2O�TH2CO3+OH- | |
| C�� | Ũ����������Һ��������SO2���壺SO2+2OH-�TSO32-+H2O | |
| D�� | ��С�մ���Һ�м��������Һ��HCO3-+H+�TCO2��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
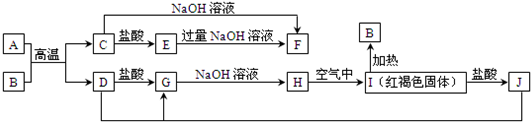
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�22.4L H2O���еķ�����ΪNA | |
| B�� | ���³�ѹ�£�1.06��Na2CO3���е�Na������Ϊ0.02NA | |
| C�� | ͨ��״���£�1NA��H2����ռ�е����Ϊ22.4L | |
| D�� | ���ʵ���Ũ��Ϊ0.5mol/L��MgCl2��Һ�У�����Cl���Ӹ���ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | b mol | B�� | ��a-b��mol | C�� | $\frac{1}{2}$��a-b��mol | D�� | $\frac{1}{2}$��a+b��mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | lmolNa��������02��Ӧ����Na20��Na2O2��ʧȥ�ĵ�����ΪNA | |
| B�� | ��״���£�44.8LHF����������Ϊ2NA | |
| C�� | ��̼������Һ�У���c��C032-��=lmol•L-1����c��Na+��=2mol•L-l | |
| D�� | ��֪2SO2��g��+02��g��?2SO3��g������H=-akJ��mol-l��2NA��SO2��NA��02��ϳ�ַ�Ӧ�ų�akJ������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com