
| A. | 古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | Ba2+对人体无毒,故BaSO4在医学上可用作钡餐 | |
| C. | 侯氏制碱法工业过程中应用了物质溶解度的差异 | |
| D. | “煤改气”、“煤改电”等工程有利于减少雾霾 |
分析 A.明矾水解显酸性,可与铜锈反应;
B.Ba2+可使蛋白质发生变性;
C.侯氏制碱法工业利用碳酸氢钠的溶解度小的性质;
D.“煤改气”、“煤改电”等工程均可减少固体颗粒物排放.
解答 解:A.明矾水解显酸性,可与铜锈反应,则古代利用明矾溶液的酸性清除铜镜表面的铜锈,故A正确;
B.Ba2+可使蛋白质发生变性,对人体有毒,但BaSO4在医学上可用作钡餐,BaSO4不溶于盐酸,故B错误;
C.侯氏制碱法工业利用碳酸氢钠的溶解度小的性质,则碳酸氢钠易从溶液中析出,故C正确;
D.“煤改气”、“煤改电”等工程均可减少固体颗粒物排放,有利于减少雾霾,故D正确;
故选B.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意化学与生活、环境的联系,题目难度不大.


科目:高中化学 来源: 题型:选择题
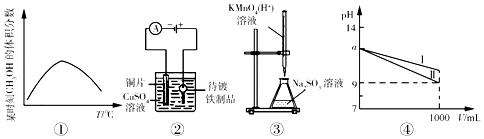
| A. | 图①表示可逆反应“CO(g)+2H2(g)?CH3OH(g)”的△H<0 | |
| B. | 利用图②所示装置,可以实现在铁制品上镀铜 | |
| C. | 图③表示在实验室中用酸性KMnO4溶液滴定Na2SO3溶液 | |
| D. | 图④表示pH=a的NH3•H2O、NaOH稀释过程,其中线I表示NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

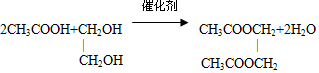 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
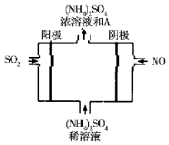 近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:
近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 物质 温度/℃ | 活性炭 | NO | CO2 | N2 |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
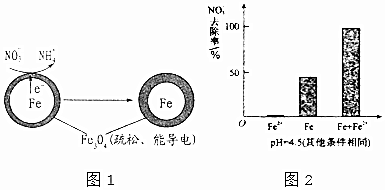
| 初始pH | pH=2.5 | pH=4.5 |
| 1小时pH | 接近中性 | 接近中性 |
| 24小时pHNO3-的去除率 | 接近100% | <50% |
| 铁的最终物质形态 | 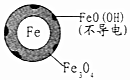 | 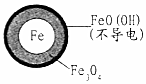 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(Z)>r(W)>r(Y)>r(X) | |
| B. | Y的简单气态氢化物的热稳定性比W的强 | |
| C. | Z3W中既含有离子键又含有共价键 | |
| D. | X的单质不能与Y的最高价氧化物对应的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从海水中可提取镁,电解熔融氯化镁可制得金属镁 | |
| B. | 研制高性能的耐磨轮胎,可减少PM2.5等细颗粒物的产生 | |
| C. | 玛瑙、水晶、钻石、红宝石等装饰品的主要成分都是硅酸盐 | |
| D. | 开发二氧化碳制成的全降解塑料,缓解日益严重的“白色污染” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
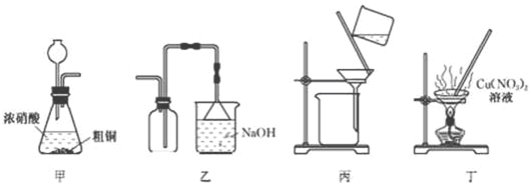
| A. | 用装置中制备NO2 | B. | 用装置乙收集NO2 | ||
| C. | 用装置丙过滤除去固体杂质 | D. | 装置丁蒸发至干得纯净硝酸铜晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com