
在给定条件的水溶液中能大量共存的粒子组是()
A. 无色透明的溶液:Fe3+、K+、OH﹣、NO3﹣
B. 与Al反应生成H2的溶液:Na+、Ma2+、NO3﹣、HCO3﹣
C. c(OH﹣)=1mol/L的溶液:K+、Ca2+、Cl﹣、H2SO3
D. CH3COOH:SO42﹣、Cl﹣、Cu2+、NH4+
考点: 离子共存问题.
分析: A.有颜色的离子不能大量共存;
B.与Al反应生成H2的溶液,可能呈强碱性,或为非氧化性酸;
C.碱性条件下H2SO3不能大量共存;
D.离子之间不发生反应.
解答: 解:A.Fe3+有颜色,且与OH﹣不能大量共存,故A错误;
B.与Al反应生成H2的溶液,可能呈强碱性,或为非氧化性酸,无论呈酸性还见碱性,HCO3﹣都不能大量共存,故B错误;
C.碱性条件下H2SO3不能大量共存,故C错误;
D.酸性条件下,离子之间不发生反应,可大量共存,故D正确.
故选D.
点评: 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的考查,题目难度不大.


科目:高中化学 来源: 题型:
“类推”是一种常用的学习方法,但有时会产生错误的结论,下列类推结论中正确的是( )
|
| A. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 |
|
| B. | 第二周期元素氢化物的稳定性序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 |
|
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 |
|
| D. | 干冰(CO2)是分子晶体,则SiO2也是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在.有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:
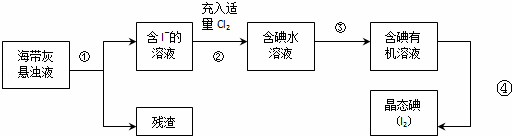
(1)步骤①需要用到的玻璃仪器(除烧杯外)还有
(2)指出提取碘的过程中有关的实验操作名称:③ .
查看答案和解析>>
科目:高中化学 来源: 题型:
在①NaCl、②NaOH、③N2、④H2S、⑤Na2O2⑥Ar中只含有离子键的是①,只含有共价键的是③④,既含离子键又含共价键的是②⑤,没有化学键的是⑥.
(2)写出下列物质的电子式:
CO2 NaCl H2O2
(3)用电子式表示下列化合物的形成过程:
CaF2: H3:
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中错误的是()
A. 进行蒸发操作时,应加热至混合物中有大量晶体析出时停止加热,用余热蒸干
B. 进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源: 题型:
NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒,已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.下列说法正确的是()
A. NaNO2在反应中被氧化
B. NaI是还原产物
C. 若反应过程中转移2mole﹣,则生成标准状况下NO的体积为44.8L
D. 氧化剂与还原剂之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
完成并配平下列方程式(在横线上填写化学计量数,在方框内填写化学式):
Fe(OH)3+ +3KClO﹣ K2FeO4+ KCl+ H2O
(2)用一种试剂除去BaCl2溶液中含有的HCl,写出所用试剂及离子方程式.除杂试剂: .离子方程式
(3)鉴别饱和碳酸氢溶液和BaCl2溶液,可选用鉴别的试剂有(填编号) .
A.盐酸B.碳酸钠溶液C.澄清石灰水D.氨水
依次写出鉴别中有明显现象的反应的离子方程式 ;
少量澄清石灰水:
或过量澄清石灰水: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是()
A. 在共价化合物中不可能含有离子键
B. 非金属之间形成的化学键一定是共价键
C. 含有共价键的化合物不一定是共价化合物
D. 含有离子键的化合物一定是离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com