
【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种常见的氮氧化物,其中一种呈红棕色。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
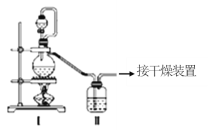
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:为制备纯净干燥的气体,下表中缺少的药品是:
制备原料 | 装置Ⅰ | 装置Ⅱ | |
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①__ | 饱和食盐水 |
制备纯净NO | Cu | 稀硝酸 | ②__ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
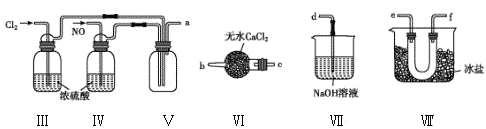
①装置连接顺序为a→____(按气流自左向右方向,用小写字母表示)。
②为了使气体充分反应,实验中先通入Cl2,待装置Ⅴ中充满黄绿色气体时,再将NO缓缓通入,此操作的目的是______(回答一条即可)。
③装置Ⅴ生成NOCl的化学方程式是________。
④装置Ⅵ的作用为___,若无该装置,Ⅷ中NOCl可能发生反应的化学方程式为__。
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:
取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为bmL。亚硝酰氯(NOCl)的质量分数为______(用代数式表示即可)。
【答案】浓盐酸 水 e→f(或f→e)→c→b→d 可以排尽装置中的空气(或答防止NO被装置中的O2氧化为NO2) Cl2+2NO=2NOCl 防止水蒸气进入收集装置和反应器中 2NOCl+H2O=2HCl+NO↑+NO2↑ ![]() %
%
【解析】
(1)在实验室中用MnO2与浓盐酸混合加热制取Cl2,浓盐酸具有挥发性,所以生成的氯气中含有杂质HCl,先用饱和食盐水除去氯气中的HCl,再通过浓硫酸干燥,得到纯净Cl2;在实验室中用Cu与稀硝酸混合加热制取NO,硝酸具有挥发性,先用水除去NO中的HNO3,再通过浓硫酸干燥,得到纯净NO;
将氯气和NO干燥后在装置V中发生反应,在冰盐中冷凝收集NOCl,氯气、NO以及NOCl均不能排放到空气中,用氢氧化钠溶液吸收,NOCl遇水易水解,故在收集装置和尾气处理装置之间需加一个干燥装置,据此进行解答。
(1)实验室用浓盐酸和二氧化锰制取氯气,氯气中含有HCl,用饱和食盐水除去HCl,用浓硫酸除去水蒸气,所以分液漏斗中是浓盐酸,装置II中为饱和食盐水;实验室用Cu和稀硝酸制取NO,NO易被氧气氧化生成NO2,硝酸的挥发性导致生成的NO含有硝酸,用水吸收硝酸和二氧化氮气体,所以分液漏斗中是稀硝酸、装置II中是水;
(2)①将Cl2和NO干燥后在装置V中发生反应,在冰盐中冷凝收集NOCl,Cl2、NO以及NOCl都是大气污染物,均不能排放到空气中,用NaOH溶液吸收,但NOCl遇水易发生水解反应,所以在收集装置和尾气处理装置之间需加一个干燥装置,故装置接口为:a→e→f(或f→e)→c→b→d;
②组装好实验装置后应先检查装置的气密性,再装入药品。因为实验室用Cu和稀硝酸制取NO,NO易被氧气氧化生成NO2;且亚硝酰氯遇水易反应生成一种无氧酸和两种氮的常见氧化物,所以实验中要先通入Cl2,待装置Ⅴ中充满黄绿色气体时,再将NO缓缓通入,此操作既可以排尽装置中的空气,同时也可以防止NO被装置中的O2氧化为NO2;
③装置Ⅴ生成Cl2与NO反应产生NOCl,反应的化学方程式是Cl2+2NO=2NOCl;
④NOCl遇水易水解,故在收集装置和尾气处理装置之间需加一个装置干燥装置VI,防止水蒸气进入反应器和收集装置中,若无该装置,Ⅷ中NOCl可能发生反应的化学方程式为2NOCl+H2O=2HCl+NO↑+NO2↑;
②根据原子守恒得关系式NOCl-HCl-AgCl-AgNO3,25.00mL亚硝酰氯水溶液中n(NOCl)=n(HCl)=n(AgNO3)=cmol/L×b×10-3L=bc×10-3mol,则250mL溶液中n(NOCl)=bc×10-2mol,m(NOCl)= bc×10-2mol×65.5g/mol=0.655bcg,因此亚硝酰氯质量分数=![]() ×100%=
×100%=![]() ×100%=
×100%=![]() %。
%。


科目:高中化学 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子几何构型不正确的是( )
A.PCl3中 P原子sp3杂化,为三角锥形
B.BCl3中B原子sp2杂化,为平面三角形
C.CS2中C原子sp杂化,为直线形
D.H2S中S原子sp杂化,为直线形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BrF3是应用最广泛的一种卤素互化物,还是一种很好的溶剂,它能与H2O反应生成Br2、HBrO3、O2和HF。下列说法正确的是( )
A.该反应中,有三种元素化合价发生改变
B.该反应的还原剂为BrF3,氧化产物为O2
C.生成0.1molO2,有0.4mole-转移
D.0.9molBrF3参加反应,被H2O还原的BrF3为0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,△H1=-393.5 kJmol-1,△H2=-395.4 kJmol-1,下列说法或表示式正确的是( )
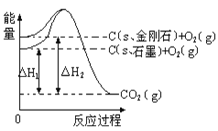
A. C(s、石墨)==C(s、金刚石)△H=+1.9kJmol-1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3在工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图及操作步骤如下:
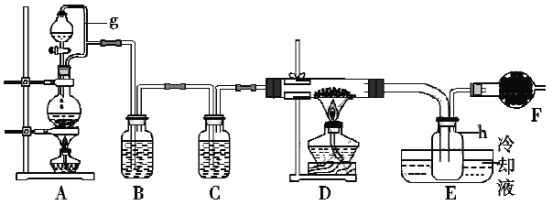
请回答下列问题:
(1)装置A中g管的作用是___;装置B中的试剂是___;E处左方选用较粗玻璃管的原因是___;装置F中盛碱石灰干燥管的作用是___。
(2)检验装置的气密性;点燃A处的酒精灯。写出装置A中发生反应的离子方程式___。
当h中充满黄绿色气体时点燃D处铁屑下方的酒精灯。反应结束,将收集器h密封。
(3)检验收集器h收集到的是FeCl3而木是FeCl2步骤是:①取收集器中的少量样品溶于少量浓盐酸,加水稀释,将溶液分为两份;②一份溶液检验出三价铁离子;③另一份溶液不能检验出二价铁离子。
①中盐酸的作用是___;②中检验出三价铁离子的离子方程式___。③检验无二价铁离子的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的合成氨的方法如图所示,下列说法错误的是

A.反应①属于“氮的固定”
B.反应②属于非氧化还原反应
C.反应③可通过电解LiOH水溶液实现
D.上述三步循环的总反应方程式为2N2+6H2O=4NH3+3O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为原电池装置示意图。
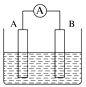
(1)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是________(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式:______________________________。
(2)若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4===2PbSO4+2H2O。写出B电极反应式:__________________________;该电池在工作时,A电极的质量将________(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1 mol H2SO4,则转移电子的数目为________。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为氢氧燃料电池,写出A电极反应式:___________________________________;该电池在工作一段时间后,溶液的碱性将________(填“增强”“减弱”或“不变”)。
(4)若A、B均为铂片,电解质为H2SO4溶液,分别从A、B两极通入CH4和O2,该电池即为甲烷燃料电池,写出A电极反应式:___________________________________;若该电池反应消耗了6.4克CH4,则转移电子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是__。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪去,有白色沉淀A产生。
①针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:
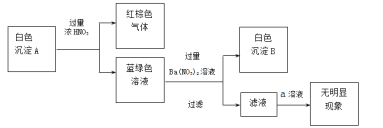
请回答:
Ⅰ.根据白色沉淀B是__(填化学式),判断沉淀A中一定存在CuSCN。
Ⅱ.仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:__。
Ⅲ.向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是__(填化学式)。
根据以上实验,证明A仅为CuSCN。
②进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整: Cu2++ SCN-= CuSCN↓+ (SCN)2__
③结合上述过程以及Fe(SCN)3Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:__。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是__或__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com