
【题目】中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛的用途,其部分生产流程如图所示。
FeCl3·6H2O![]() FeOOH
FeOOH![]() 纳米四氧化三铁
纳米四氧化三铁
下列有关叙述不正确的是
A.纳米四氧化三铁可分散在水中,其与FeCl3溶液中分散质的直径相当
B.纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病
C.在反应①中环丙胺的作用可促进氯化铁水解
D.反应②的化学方程式是6FeOOH+CO![]() 2Fe3O4+3H2O+CO2
2Fe3O4+3H2O+CO2
科目:高中化学 来源: 题型:
【题目】某同学购买了一瓶“84消毒液”,包装说明如下:

请根据以上信息和相关知识判断,下列分析不正确的是
A.该“84消毒液”的物质的量浓度为 4.0 mol·L1
B.一瓶该“84消毒液”能吸收空气中44.8 L的CO2(标准状况)而变质
C.取100 mL该“84消毒液”稀释100倍后用以消毒,稀释后的溶液中c(Na+)约为0.04 mol·L1
D.参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液,需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2015·新课标全国卷Ⅰ]NA为阿伏加德罗常数的值。下列说法正确的是
A.18 gD2O和18 gH2O中含有的质子数均为10NA
B.2 L 0.5 mol·L1亚硫酸溶液中含有的H+离子数为2NA
C.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
D.密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

(1)该浓盐酸的物质的量浓度为___________mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_________。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生现需450 mL物质的量浓度为0.3 mol/L稀盐酸。
①该学生需要量取___________ mL上述浓盐酸进行配制。
②配制时正确的操作顺序是(用字母表示)________;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中, 用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1—2cm处
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏高”或“偏低”或“无影响”)。
I、用量筒量取浓盐酸时俯视观察凹液面____________;
II、用量筒量取浓盐酸后,洗涤量筒2~3次,洗涤液也转移到容量瓶_________;
III、溶液注入容量瓶前没有恢复到室温就进行定容____________。
(4)若在标准状况下,将V LHCl气体溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为________mol/L。(填字母)(2分)
![]()
![]()
![]()
![]()
(5)现将100mL 0.5mol/L的盐酸与200mL 0.1mol/LCuCl2溶液混合,体积变化忽略不计,所得溶液中Cl-的物质的量浓度是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布。下图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成。下列说法正确的是
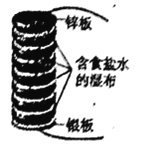
A. 该原电池正极的电极方程式为:O2+4e-+4H+==2H2O
B. 电池长时间工作后,中间的布上会有白色固体颗粒生成,该固体颗粒为Ag2O
C. 当电路中转移0.2 mol电子时,消耗锌板的总质量为52 g
D. 该伏打电堆工作时,在银板附近会有Cl2放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冰晶石又名六氟铝酸钠(Na3A1F6)白色固体,微溶于水,常用作电解铝工业的助熔剂。工业上用萤石(主要成分是CaF2)、浓硫酸、氢氧化铝和碳酸钠溶液通过湿法制备冰晶石,某化学实验小组模拟工业上制取Na2AlF6的装置图如下(该装置均由聚四氟乙烯仪器组装而成)。
已知:CaF2+H2SO4![]() CaSO4+2HF↑
CaSO4+2HF↑

(1)实验仪器不能使用玻璃仪器的原因是_____________(用化学方程式表示)。
(2)装置III的作用为______________________。
(3)在实验过程中,装置II中有CO2气体逸出,同时观察到有白色固体析出,请写出该反应的离子反应方程式:__________________。
(4)在实验过程中,先向装置II中通入HF气体,然后再滴加Na2CO3溶液,而不是先将Na2CO3和A1(OH)3混合后再通入HF气体,其原因是_______________。 .
(5)装置II反应后的混合液经过过滤可得到Na3A1F6晶体,在过滤操作中确定沉淀已经洗涤干净的方法是_____________________。
(6)在电解制铝的工业生产中,阳极的电极反应式为_____________。
(7)萤石中含有少量的Fe2O3杂质,可用于装置I反应后的溶液来测定氟化钙的含量。具体操作如下:取8.0 g萤石加入装置I中,完全反应后,将混合液加稀释,然后加入足量的KI固体,再以淀粉为指示剂,用0.1000 mol·L-1 Na2S2O3标准溶液滴定,当出现_________现象时,到达滴定终点,消耗Na2S2O3标准溶液40.00mL,则萤石中氟化钙的百分含量为______________。(已知:I2+2S2O32-==S4O62-+2I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期火箭发动机使用的推进剂为液氧和汽油。火箭发射过程中,推进剂的燃烧是将( )
A. 化学能转化为热能 B. 动能转化为热能
C. 化学能转化为电能 D. 热能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

①浸取反应中氧化剂的化学式为________ ;滤渣Ⅰ的成分为MnO2、S和___________(写化学式)。
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液PH为4后,溶液中铜离子最大浓度不超过_______ mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
③“沉锰”(除Mn2+)过程中反应的离子方程式_________________________ 。
④滤液Ⅱ经蒸发结晶得到的盐主要是______________ (写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00 g,则电解过程中盐桥中Cl-移向______________(填“甲池”或“乙池”)

②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH________(填“减小”、“增大”或“不变”) ,乙池中石墨为________极(填“正”、“负”、“阴”或“阳”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是你,化学是我,化学深入我们生活,下列说法正确的是
A. 木材纤维和土豆淀粉遇碘水均显蓝色
B. 食用花生油和鸡蛋清都能发生水解反应
C. 包装用材料聚乙烯和聚氯乙烯都属于烃
D. PX项目的主要产品对二甲苯属于饱和烃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com