

 CO(NH2)2 (l) + H2O (l)���÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ���£�
CO(NH2)2 (l) + H2O (l)���÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ���£�| T / �� | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
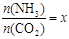 ����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ����_______��
����ͼ�ǰ�̼�ȣ�x����CO2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ����_______��
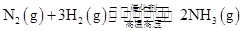
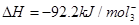
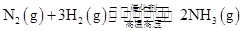
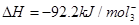 �����ڸ÷�Ӧ�ǿ��淴Ӧ����2 mol N2��6 mol H2��ȫ��Ӧ�����Ͽ��Էų�184.4 kJ����������ʵ���еõ���ֻ�ܱ�184.4 kJ�����Ԣ�����ʼʱ�������ڷ���2 mol N2��6 mol H2����ƽ���ų�������ΪQ<184.4 kJ��
�����ڸ÷�Ӧ�ǿ��淴Ӧ����2 mol N2��6 mol H2��ȫ��Ӧ�����Ͽ��Էų�184.4 kJ����������ʵ���еõ���ֻ�ܱ�184.4 kJ�����Ԣ�����ʼʱ�������ڷ���2 mol N2��6 mol H2����ƽ���ų�������ΪQ<184.4 kJ��
| T / �� | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
 CO(NH2)2 (l) + H2O (l)����NH3��Ũ�ȣ�ƽ���������Ӧ�����ƶ�������CO2ƽ��ת���ʻ�����
CO(NH2)2 (l) + H2O (l)����NH3��Ũ�ȣ�ƽ���������Ӧ�����ƶ�������CO2ƽ��ת���ʻ�����  CO(NH2)2 (l) + H2O (l)
CO(NH2)2 (l) + H2O (l)

 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���÷�ӦΪ���ȷ�Ӧ |
| B��H2������һ������HCl |
C����ӦHCl(g)��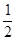 H2(g)+ H2(g)+ 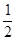 Cl2(g) �� ��HΪ +92.3 kJ��mol-1 Cl2(g) �� ��HΪ +92.3 kJ��mol-1 |
| D���÷�ӦΪ���ȷ�Ӧ���ʲ��ؼ��ȾͿɷ�����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
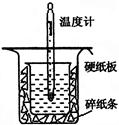
| �ζ����� | ����NaOH��Һ�����/mL | 0.1000 mol/L��������/mL | ||
| �ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
| ��һ�� | 25.00 | 0.00 | 26.11 | 26.11 |
| �ڶ��� | 25.00 | 1.56 | 30.30 | 28.74 |
| ������ | 25.00 | 0.22 | 26.31 | 26.09 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Ӧ2NO2==O2+2NO����H="+116.2kJ/mol" �κ�������Է� |
| B��Na2CO3��Һ�У�c(Na+)=2c(CO32��)+2c(HCO3��)+2c(H2CO3) |
| C����ʾ̼ȼ���ȵ��Ȼ�ѧ����ʽΪ C(s)��O2(g)��CO2(g)�� ��H����393.5kJ/mol |
| D�������ʵ�����KHCO3��Ba(OH)2����Һ��ϣ�HCO3��+ Ba2++OH�� �� BaCO3�� + H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 mol
mol�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢ڢۢܢ� | B���ڢ� | C���٢ۢܢ� | D���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A����֪2SO2(g)+O2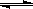 2SO3(g) Ϊ���ȷ�Ӧ����SO2������һ������SO3������ 2SO3(g) Ϊ���ȷ�Ӧ����SO2������һ������SO3������ |
| B����֪C(ʯī,s) ===C�����ʯ,s�� ��H��0������ʯ��ʯī�ȶ� |
| C��NaOH(aq)��HCl(aq)===NaCl(aq)��H2O(l)����H����57.4 kJ/mol����20 g NaOH����Һ������ϡ������ȫ��Ӧ���ų�������Ϊ28.7 kJ |
| D����֪2C(s) +2O2 (g) ===2CO2(g) ��H1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����lmol����ת��ɺ���ʱ�ų�17kJ���� |
| B����4g����ת��ɰ���ʱ����17kJ���� |
| C������Ӧ��һ�����ȷ�Ӧ |
| D���������ȶ��ԱȺ��״� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����ڷ�Ӧ2H2O2="=2H2O+O2��," ����MnO2�������¶ȶ��ܼӿ�O2�������� |
| B��������ƽ������0.01mol/L��min��Ҫ��ȡ500mL�������ܶ�1.28g/L����ʱ��4min |
| C�����ݻ�ѧ��Ӧ�е���ЧӦ����Ӧ��Ϊ���ȷ�Ӧ�����ȷ�Ӧ |
| D������ȼ�ϵ�ط��磬������ֱ���ڿ�����ȼ������ת���ʸ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com