
| A. | 易溶于水 | B. | 碱性 | C. | 酸性 | D. | 还原性 |
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2N2O4═4NaNO3 | B. | Na2O2+2NO2═2NaNO2+O2 | ||
| C. | 2Na2O2+2N2O3═4NaNO2+O2 | D. | 2Na2O2+2 Mn2O7═4Na2MnO4+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN的结构式:H-C≡N | |
| B. | S2-的结构示意图: | |
| C. | HClO的电子式: | |
| D. | 质子数为86、中子数为51的铯原子:$\stackrel{137}{86}$Cs |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水反应的实质是Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| B. | 存在于污水中的重金属离子,常用投加明矾等电解质的方法进行处理 | |
| C. | 镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液 | |
| D. | 依据铝热反应原理,能发生反应2Al+3MgO$\frac{\underline{\;高温\;}}{\;}$3Mg+Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 298K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行,则其△H>0 | |
| B. | 乙醇、乙二醇、丙三醇互为同系物;H2、D2、T2互为同素异形体 | |
| C. | 用一定浓度的稀盐酸滴定未知浓度的氨水,若选用酚酞作指示剂,会使测定出的氨水物质的量浓度偏低 | |
| D. | 饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,涉及原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2 Al(OH)3↓+3BaSO4↓ | |
| C. | 向FeBr2溶液中通入少量氯气:Br-+Cl2═Br2+2Cl- | |
| D. | SO2通入溴水中:SO2+Br2+2H2O═2H++SO42-+HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮可以形成多种化合物,如NO、NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NO、NH3、N2H4、HCN、NH4NO3等. 2CO2+N2,反应过程中部分物质的浓度变化如图所示:
2CO2+N2,反应过程中部分物质的浓度变化如图所示: 2CO2+N2.
2CO2+N2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
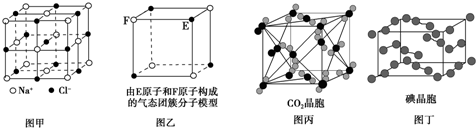
| A. | 在NaCl晶体(图甲)中,距Na+最近的Cl-形成正八面体 | |
| B. | 该气态团簇分子(图乙)的分子式为E4F4或F4E4 | |
| C. | 在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻 | |
| D. | 在碘晶体(图丁)中,碘分子的排列只有一种方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 | |
| B. | 反应A(g)?2B(g);若正反应的活化能为Ea kJ•mol-1,逆反应的活化能为Eb kJ•mol-1,则该反应的△H=(Ea-Eb)kJ•mol-1 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,平衡时氢气转化率增大 | |
| D. | 吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com