
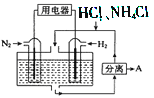
ΓΨΧβΡΩΓΩ IΘ°ΙΛ“Β…œ”Οœ¥ΨΜΒΡΖœΆ≠–ΦΉς‘≠Νœά¥÷Τ±ΗœθΥαΆ≠ΓΘΈΣΝΥΫΎ‘Φ‘≠ΝœΚΆΖά÷ΙΈέ»ΨΜΖΨ≥Θ§“Υ≤…»ΓΒΡΖΫΖ® « Θ®Χν–ρΚ≈Θ©
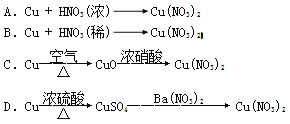
ΔρΘ°œ¬ΆΦ «”ΟΙΐΝΩΒΡΆ≠”κ40mLœΓœθΥα‘Ύ100mL…’ΤΩ÷–Ζ¥”Π÷Τ»Γ“Μ―θΜ·ΒΣΤχΧεΒΡ Β―ιΉΑ÷ΟΆΦΘ§«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ

Θ®1Θ©«κ‘Ύ”“Ωρ÷–Μ≠≥ωΤχΧε ’Φ·ΉΑ÷ΟΒΡΉΑ÷ΟΆΦΓΘ
Θ®2Θ©ΔΌ¥”…’ΤΩ÷–»Γ≥ω…ΌΝΩΖ¥”ΠΚσΒΡ»ή“ΚΘ§ΒΈ»κ…ΌΝΩΑ±Υ°Θ§–¥≥ωΗΟΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘΚ _______________
ΔΎΖ¥”ΠΫα χΚσΘ§ΡήΖώ≤…»Γœρ…’ΤΩ÷–‘ΌΦ”»κœΓΝρΥαΒΡΖΫ ΫΘ§‘ΌΜώΒΟ“Μ―θΜ·ΒΣΤχΧεΘΩ»γΙϊΩ…“‘Θ§«κ–¥≥ωΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘ§»γΙϊ≤ΜΩ…“‘Θ§«κΥΒΟςάμ”…ΘΚ_________________________________
Θ®3Θ©Φλ≤ι…œΆΦΉΑ÷ΟΤχΟή–‘ΒΡ≤ΌΉς «ΘΚ ΓΘ
ΓΨ¥πΑΗΓΩ
IΘ°Θ®1Θ©CΘΜ
ΔρΘ°Θ®1Θ© ΘΜ
ΘΜ
Θ®2Θ©ΔΌCu2+ + 2NH3ΓΛH2O=Cu(OH)2Γΐ+ 2NH4+Θ®2Ζ÷Θ©ΘΜ
ΔΎ 3Cu + 8H+ + 2NO3Θ≠=3Cu + 2NOΓϋ+ 4H2OΘ®2Ζ÷Θ©ΘΜ
Θ®3Θ©ΫΪΒΦΤχΙήΡ©ΕΥ…λ»κΥ°÷–Θ§”Ο ÷Έφ»»…’ΤΩΘ§ΒΦΤχΙήΡ©ΕΥ”–Τχ≈ίΖ≈≥ωΘ§ά以“ΜΕΈ ±ΦδΚσΒΦΙή÷–…œ…ΐ“ΜΕΈΥ°÷υΘ§÷ΛΟςΉΑ÷ΟΤχΟή–‘ΝΦΚΟΓΘΘ®2Ζ÷Θ©
ΓΨΫβΈωΓΩ
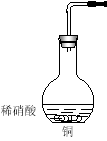
‘ΧβΖ÷ΈωΘΚIΘ°AΘ°≈®œθΥα”κΆ≠Ζ¥”Π…ζ≥…Έέ»Ψ–‘ΤχΧεNO2Θ§¥μΈσΘΜBΘ°œΓœθΥα”κΆ≠Ζ¥”Π…ζ≥…Έέ»Ψ–‘ΤχΧεNOΘ§¥μΈσΘΜCΘ°Ά≠”κ―θΤχΖ¥”Π…ζ≥…CuOΘ§”κœθΥαΖ¥”ΠœϊΚΡœθΥαΉν…ΌΘ§«“ΟΜ”–…ζ≥…Έέ»Ψ–‘ΤχΧεΘ§’ΐ»ΖΘΜDΘ°Ά≠”κ≈®ΝρΥαΖ¥”Π…ζ≥…Έέ»Ψ–‘ΤχΧεΕΰ―θΜ·ΝρΘ§¥μΈσΘΜΔρΘ°Θ®1Θ©NO≤Μ»ή”ΎΥ°Θ§Ω…”Ο≈≈Υ°Ζ® ’Φ·Θ§ΉΑ÷ΟΈΣ ΘΜΘ®2Θ©ΔΌ…’ΤΩ÷–Ζ¥”ΠΚσΒΡ»ή“ΚΈΣœθΥαΆ≠Θ§œθΥαΆ≠”κΑ±Υ°Ζ¥”Π…ζ≥…«β―θΜ·Ά≠≥ΝΒμΚΆœθΥαοßΘ§Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚCu2+ + 2NH3ΓΛH2O=Cu(OH)2Γΐ+ 2NH4+ΘΜΔΎΖ¥”ΠΚσΒΡ»ή“Κ÷–Κ§”–œθΥαΗυάκΉ”Θ§Φ”»κœΓΝρΥαΘ§ΧαΙ©«βάκΉ”Θ§‘ΎΥα–‘ΧθΦΰœ¬Θ§H+ΓΔNO3-ΓΔCuΜαΖΔ…ζ―θΜ·ΜΙ‘≠Ζ¥”Π≤ζ…ζNOΘ§”κΆ≠ΦΧ–χΖ¥”Π…ζ≥…NOΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚ3Cu + 8H+ + 2NO3Θ≠=3Cu + 2NOΓϋ+ 4H2OΘΜΘ®3Θ©”…”ΎΖ¥”Π”…ΤχΧε≤ΈΦ”Θ§Υυ“‘ Ήœ»“ΣΦλ≤ιΉΑ÷ΟΒΡΤχΟή–‘Θ§Φλ≤ιΒΡΖΫΖ® «ΫΪΒΦΤχΙήΡ©ΕΥ…λ»κΥ°÷–Θ§”Ο ÷Έφ»»…’ΤΩΘ§ΒΦΤχΙήΡ©ΕΥ”–Τχ≈ίΖ≈≥ωΘ§ά以“ΜΕΈ ±ΦδΚσΒΦΙή÷–…œ…ΐ“ΜΕΈΥ°÷υΘ§÷ΛΟςΉΑ÷ΟΤχΟή–‘ΝΦΚΟΓΘ
ΘΜΘ®2Θ©ΔΌ…’ΤΩ÷–Ζ¥”ΠΚσΒΡ»ή“ΚΈΣœθΥαΆ≠Θ§œθΥαΆ≠”κΑ±Υ°Ζ¥”Π…ζ≥…«β―θΜ·Ά≠≥ΝΒμΚΆœθΥαοßΘ§Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚCu2+ + 2NH3ΓΛH2O=Cu(OH)2Γΐ+ 2NH4+ΘΜΔΎΖ¥”ΠΚσΒΡ»ή“Κ÷–Κ§”–œθΥαΗυάκΉ”Θ§Φ”»κœΓΝρΥαΘ§ΧαΙ©«βάκΉ”Θ§‘ΎΥα–‘ΧθΦΰœ¬Θ§H+ΓΔNO3-ΓΔCuΜαΖΔ…ζ―θΜ·ΜΙ‘≠Ζ¥”Π≤ζ…ζNOΘ§”κΆ≠ΦΧ–χΖ¥”Π…ζ≥…NOΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚ3Cu + 8H+ + 2NO3Θ≠=3Cu + 2NOΓϋ+ 4H2OΘΜΘ®3Θ©”…”ΎΖ¥”Π”…ΤχΧε≤ΈΦ”Θ§Υυ“‘ Ήœ»“ΣΦλ≤ιΉΑ÷ΟΒΡΤχΟή–‘Θ§Φλ≤ιΒΡΖΫΖ® «ΫΪΒΦΤχΙήΡ©ΕΥ…λ»κΥ°÷–Θ§”Ο ÷Έφ»»…’ΤΩΘ§ΒΦΤχΙήΡ©ΕΥ”–Τχ≈ίΖ≈≥ωΘ§ά以“ΜΕΈ ±ΦδΚσΒΦΙή÷–…œ…ΐ“ΜΕΈΥ°÷υΘ§÷ΛΟςΉΑ÷ΟΤχΟή–‘ΝΦΚΟΓΘ


 “Μ≈Β ι“Β νΦΌΉς“ΒΩλά÷ΦΌΤΎ‘ΤΡœΟά θ≥ωΑφ…γœΒΝ–¥πΑΗ
“Μ≈Β ι“Β νΦΌΉς“ΒΩλά÷ΦΌΤΎ‘ΤΡœΟά θ≥ωΑφ…γœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΑ±Τχ‘Ύ…ζ≤ζΓΔ…ζΜνΚΆΩΤ―–÷–”Π”Ο °Ζ÷ΙψΖΚΓΘ
Θ®1Θ©ΔΌSNCR-SCR «“Μ÷÷–¬–ΆΒΡ―ΧΤχΆ―œθΦΦ θΘ®≥ΐ»Ξ―ΧΤχ÷–ΒΡNOxΘ©Θ§SNCR-SCRΝς≥Χ÷–ΖΔ…ζΒΡ÷ς“ΣΖ¥”Π”–ΘΚ
4NOΘ®gΘ©+4NH3Θ®gΘ©+O2Θ®gΘ© ![]() 4N2Θ®gΘ©+6H2OΘ®gΘ©ΓςH=-1627Θ°2kJmol-1ΘΜ
4N2Θ®gΘ©+6H2OΘ®gΘ©ΓςH=-1627Θ°2kJmol-1ΘΜ
6NOΘ®gΘ©+4NH3Θ®gΘ© ![]() 5N2Θ®gΘ©+6H2OΘ®gΘ©ΓςH=-1807Θ°0kJmol-1ΘΜ
5N2Θ®gΘ©+6H2OΘ®gΘ©ΓςH=-1807Θ°0kJmol-1ΘΜ
6NO2Θ®gΘ©+8NH3Θ®gΘ© ![]() 7N2Θ®gΘ©+12H2OΘ®gΘ©ΓςH=-2659Θ°9kJmol-1ΘΜ
7N2Θ®gΘ©+12H2OΘ®gΘ©ΓςH=-2659Θ°9kJmol-1ΘΜ
Ζ¥”ΠN2Θ®gΘ©+O2Θ®gΘ© ![]() 2NOΘ®gΘ©ΒΡΓςH= ____________ kJmol-1
2NOΘ®gΘ©ΒΡΓςH= ____________ kJmol-1
ΔΎ“ΚΑ±Ω…“‘ΖΔ…ζΒγάκΘΚ2NH3Θ®lΘ© ![]() NH2-+NH4+Θ§COCl2ΚΆ“ΚΑ±ΖΔ…ζΓΑΗ¥Ζ÷ΫβΓ±Ζ¥”Π…ζ≥…ΡρΥΊΘ§–¥≥ωΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ____________ΘΜ
NH2-+NH4+Θ§COCl2ΚΆ“ΚΑ±ΖΔ…ζΓΑΗ¥Ζ÷ΫβΓ±Ζ¥”Π…ζ≥…ΡρΥΊΘ§–¥≥ωΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ____________ΘΜ
Θ®2Θ©Α±Τχ“Ή“ΚΜ·Θ§±ψ”Ύ¥Δ‘ΥΔΌ»τ‘ΎΚψΈ¬Κψ»ίΒΡ»ίΤςΡΎΫχ––Ζ¥”Π2NH3Θ®gΘ© ![]() N2Θ®gΘ©+3H2Θ®gΘ©ΘΜΓςH=+94Θ°4kJ/molΘ§œ¬Ν–±μ ΨΗΟΖ¥”Π¥οΒΫΤΫΚβΉ¥Χ§ΒΡ±ξ÷Ψ”–____________Θ®ΧνΉ÷ΡΗ–ρΚ≈Θ©
N2Θ®gΘ©+3H2Θ®gΘ©ΘΜΓςH=+94Θ°4kJ/molΘ§œ¬Ν–±μ ΨΗΟΖ¥”Π¥οΒΫΤΫΚβΉ¥Χ§ΒΡ±ξ÷Ψ”–____________Θ®ΧνΉ÷ΡΗ–ρΚ≈Θ©
AΘ°»ίΤς÷–ΜλΚœΤχΧεΒΡΟήΕ»±Θ≥÷≤Μ±δ
BΘ°NH3Θ®gΘ©ΑΌΖ÷Κ§ΝΩ±Θ≥÷≤Μ±δ
CΘ°»ίΤς÷–ΜλΚœΤχΧεΒΡ―Ι«Ω±Θ≥÷≤Μ±δ
DΘ°”–3ΗωH-HΦϋ…ζ≥…Ά§ ±”÷1ΗωNΓ‘NΦϋ…ζ≥…
ΔΎΤδΥϊΧθΦΰœύΆ§ ±Θ§ΗΟΖ¥”Π‘Ύ≤ΜΆ§¥ΏΜ·ΦΝΉς”Οœ¬Ζ¥”ΠΘ§œύΆ§ ±ΦδΚσΘ§Α±ΤχΒΡΉΣΜ·¬ ΥφΖ¥”ΠΈ¬Ε»ΒΡ±δΜ·»γΆΦΥυ ΨΘ°‘Ύ600Γφ ±¥ΏΜ·–ßΙϊΉνΚΟΒΡ «____________Θ®Χν¥ΏΜ·ΦΝΒΡΜ·―ß ΫΘ©Θ°cΒψΑ±ΤχΒΡΉΣΜ·¬ ΗΏ”ΎbΒψΘ§‘≠“ρ «____________ΓΘ
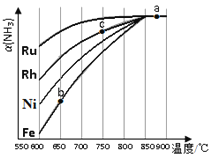
Θ®3Θ©»γΆΦ±μ Ψ Ι”Ο–¬–ΆΒγΦΪ≤ΡΝœΘ§“‘N2ΓΔH2 ΈΣΒγΦΪΖ¥”ΠΈοΘ§“‘HCl-NH4ClΈΣΒγΫβ÷ »ή“ΚΉι≥…ΒΡΦ»ΡήΧαΙ©ΡήΝΩ”÷Ρή Βœ÷ΒΣΙΧΕ®ΒΡ–¬–ΆΒγ≥ΊΓΘ«κ–¥≥ωΗΟΒγ≥ΊΒΡ’ΐΦΪΖ¥”Π Ϋ____________ΘΜ…ζ≤ζ÷–Ω…Ζ÷άκ≥ωΒΡΈο÷ AΒΡΜ·―ß ΫΈΣ____________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΦ»Ρή Ι ·»ο ‘“Κ±δΚλΘ§”÷Ρή ΙΤΖΚλ ‘“Κ±δΈΣΈό…ΪΒΡΈο÷ «Θ® Θ©
AΘ°NH3 BΘ°HCl CΘ°SO2 DΘ°CO2
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
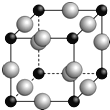
ΓΨΧβΡΩΓΩ“―÷ΣAΓΔBΓΔCΓΔDΓΔEΓΔFΕΦ «÷ήΤΎ±μ÷–«ΑΥΡ÷ήΤΎΒΡ‘ΣΥΊΘ§ΥϋΟ«ΒΡΚΥΒγΚ… ΐ“ά¥Έ‘ω¥σΓΘΤδ÷–ΜυΧ§A‘≠Ή”ΦέΒγΉ”≈≈≤Φ ΫΈΣnsnnpn+1ΘΜΜ·ΚœΈοB2EΈΣάκΉ”Μ·ΚœΈοΘ§E‘≠Ή”ΚΥΆβΒΡM≤ψ÷–÷Μ”–ΝΫΕ‘≥…Ε‘ΒγΉ”ΘΜC‘ΣΥΊ «ΒΊΩ«÷–Κ§ΝΩΉνΗΏΒΡΫπ τ‘ΣΥΊΘΜDΒΞ÷ ≥Θ”Ο”Ύ÷ΤΉςΧΪ―τΡήΒγ≥ΊΚΆΦ·≥…Βγ¬Ζ–ΨΤ§ΘΜF‘≠Ή”ΉνΆβ≤ψΒγΉ” ΐ”κBΒΡœύΆ§Θ§Τδ”ύΗςΡΎ≤ψΙλΒάΨυ≥δ¬ζΒγΉ”ΓΘ«κΗυΨί“‘…œ–≈œΔΘ§ΜΊ¥πœ¬Ν–Έ ΧβΘ®”ΟΥυΕ‘”ΠΒΡ‘ΣΥΊΖϊΚ≈±μ ΨΘ©ΘΚ
Θ®1Θ©AΓΔBΓΔEΒΡΒΎ“ΜΒγάκΡή”…–ΓΒΫ¥σΒΡΥ≥–ρΈΣ ΓΘ
Θ®2Θ©«βΜ·ΈοA2H4Ζ÷Ή”÷–A‘≠Ή”≤…»Γ ‘”Μ·ΓΘ
Θ®3Θ©Α¥‘≠Ή”ΒΡΆβΈßΒγΉ”≈≈≤ΦΖ÷«χΘ§‘ΣΥΊF‘Ύ «χΘ§ΜυΧ§F‘≠Ή”ΒΡΒγΉ”≈≈≤Φ ΫΈΣ ΓΘ
Θ®4Θ©‘ΣΥΊAΚΆCΩ…–Έ≥…“Μ÷÷–¬–ΆΜ·ΚœΈο≤ΡΝœΘ§ΤδΨßΧεΨΏ”–ΚήΗΏΒΡ”≤Ε»ΚΆ»έΒψΘ§ΤδΜ·ΚœΈο÷–ΥυΚ§ΒΡΜ·―ßΦϋάύ–ΆΈΣ ΓΘ
Θ®5Θ©AΓΔF–Έ≥…Ρ≥÷÷Μ·ΚœΈοΒΡΨßΑϊΫαΙΙ»γœ¬ΆΦΥυ ΨΘ®Τδ÷–Aœ‘©¹3ΦέΘ§ΟΩΗω«ρΨυ±μ Ψ1Ηω‘≠Ή”Θ©Θ§‘ρΤδΜ·―ß ΫΈΣ ΓΘ…ηΑΔΖϋΦ”Β¬¬ό≥Θ ΐΈΣNAΘ§ΨύάκΉνΫϋΒΡΝΫΗωF‘≠Ή”ΒΡΚΥΦδΨύΈΣa cmΘ§‘ρΗΟΨßΑϊΒΡΟήΕ»ΈΣΘ®”ΟΚ§aΚΆNAΒΡ¥ζ ΐ Ϋ±μ ΨΘ© g/cm3ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥‘ΣΥΊ÷ ΝΩ ΐ51Θ§÷–Ή” ΐ27Θ§ΤδΜυΧ§‘≠Ή”Έ¥≥…Ε‘ΒγΉ” ΐΈΣ(Θ©
A. 3 B. 4 C. 5 D. 6
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΗυΨίΓΑœύΥΤœύ»ήΓ·Θ§Ιφ¬…Θ§Ρψ»œΈΣœ¬Ν–Έο÷ ‘ΎΥ°÷–»ήΫβΕ»Ϋœ¥σΒΡ «(
AΘ°““œ© BΘ°Εΰ―θΜ·ΧΦ CΘ°Εΰ―θΜ·Νρ DΘ°«βΤχ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘Ύ»ίΜΐ≤Μ±δΒΡΟή±’»ίΤς÷–Ϋχ––Ζ¥”ΠΘΚ2SO2Θ®gΘ©ΘΪO2Θ®gΘ©![]() 2SO3Θ®gΘ© ΠΛHΘΦ0ΓΘœ¬Ν–ΗςΆΦ±μ ΨΒ±ΤδΥϊΧθΦΰ≤Μ±δ ±Θ§ΗΡ±δΡ≥“ΜΧθΦΰΕ‘…œ ωΖ¥”ΠΒΡ”ΑœλΘ§Τδ÷–Ζ÷Έω’ΐ»ΖΒΡ «Θ® Θ©
2SO3Θ®gΘ© ΠΛHΘΦ0ΓΘœ¬Ν–ΗςΆΦ±μ ΨΒ±ΤδΥϊΧθΦΰ≤Μ±δ ±Θ§ΗΡ±δΡ≥“ΜΧθΦΰΕ‘…œ ωΖ¥”ΠΒΡ”ΑœλΘ§Τδ÷–Ζ÷Έω’ΐ»ΖΒΡ «Θ® Θ©

A. ΆΦΔώ±μ ΨΈ¬Ε»Ε‘Μ·―ßΤΫΚβΒΡ”ΑœλΘ§«“ΦΉΒΡΈ¬Ε»ΫœΗΏ
B. ΆΦΔρ±μ Ψt0 ±ΩΧ Ι”Ο¥ΏΜ·ΦΝΕ‘Ζ¥”ΠΥΌ¬ ΒΡ”Αœλ
C. ΆΦΔσ±μ Ψt0 ±ΩΧ‘ω¥σO2ΒΡ≈®Ε»Ε‘Ζ¥”ΠΥΌ¬ ΒΡ”Αœλ
D. ΆΦΔτ÷–aΓΔbΓΔc»ΐΒψ÷–÷Μ”–bΒψ“―Ψ≠¥οΒΫΜ·―ßΤΫΚβΉ¥Χ§
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩRFC «“Μ÷÷ΫΪΥ°ΒγΫβΦΦ θ”κ«β―θ»ΦΝœΒγ≥ΊΦΦ θœύΫαΚœΒΡΩ…≥δΒγΒγ≥ΊΓΘ”“ΆΦΈΣRFCΙΛΉς‘≠άμ Ψ“βΆΦΘ§œ¬Ν–”–ΙΊΥΒΖ®’ΐ»ΖΒΡ «
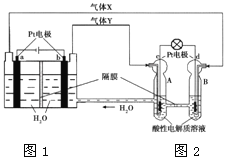
A. ΆΦ1Α―Μ·―ßΡήΉΣΜ·ΈΣΒγΡήΘ§ΆΦ2Α―ΒγΡήΉΣΜ·ΈΣΜ·―ßΡήΘ§Υ°ΒΟΒΫΝΥ―≠ΜΖ Ι”Ο
B. Β±”–0.1 molΒγΉ”ΉΣ“Τ ±Θ§aΦΪ≤ζ…ζ0.56 L O2Θ®±ξΉΦΉ¥Ωωœ¬Θ©
C. cΦΪ…œΖΔ…ζΒΡΒγΦΪΖ¥”Π «ΘΚO2+ 4H++ 4e-= 2H2O
D. ΆΦ2÷–ΒγΉ”¥”cΦΪΝςœρdΦΪΘ§ΧαΙ©ΒγΡή
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΩ’Τχ¥Β≥ωΖ®ΙΛ“’ «ΡΩ«ΑΓΑΚΘΥ°ΧαδεΓ±ΒΡΉν÷ς“ΣΖΫΖ®÷°“ΜΓΘΤδΙΛ“’Νς≥Χ»γœ¬ΘΚ
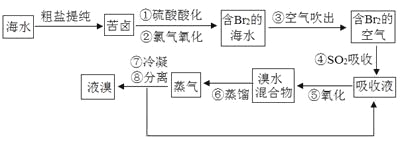
Θ®1Θ©≤Ϋ÷ηΔΌ÷–¬»Τχ―θΜ·δεάκΉ” ±‘ΎpHΘΫ3Θ°5ΒΡΥα–‘ΧθΦΰœ¬–ßΙϊΉνΚΟΘ§Β± Ι”ΟΨΪ»ΖpH ‘÷ΫΘ®ΡήΕΝ ΐΒΫ0Θ°1Θ©Φλ≤β≤Ϋ÷ηΔΎ¬»Τχ―θΜ·ΒΡ»ή“ΚΒΡpH ±Θ§ΖΔœ÷Τδ―’…Ϊ±δΜ· ß≥ΘΘ§‘ρpHΦλ≤β ßΑήΒΡ‘≠“ρ « ΓΘ
Θ®2Θ©≤Ϋ÷ηΔή÷–Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ Θ§ΗΟΖ¥”Π÷–Χεœ÷ΝΥSO2ΒΡ –‘Θ®ΧνΓΑ―θΜ·Γ±ΜρΓΑΜΙ‘≠Γ±Θ©ΓΘ
Θ®3Θ©≤Ϋ÷ηΔύ÷–δε’τΤχάδΡΐΚσΒΟΒΫ“Κδε”κδεΥ°ΒΡΜλΚœΈοΘ§‘Ύ Β―ι “Ω…”ΟΖ÷“Κ¬©ΕΖΫχ––Ζ÷άκΓΘΖ÷άκ ±¥”Ζ÷“Κ¬©ΕΖΒΡ…œΩΎΒΙ≥ωΒΡ « ΓΘ
Θ®4Θ©≤Ϋ÷ηΔΌΓΔΔΎ÷°Κσ≤ΔΈ¥÷±Ϋ””ΟΓΑΚ§Br2ΒΡΚΘΥ°Γ±Ϋχ––’τΝσΒΟΒΫ“ΚδεΘ§Εχ «Ψ≠ΙΐΓΑΩ’Τχ¥Β≥ωΓ±ΓΔΓΑSO2Έϋ ’Γ±ΓΔΓΑ―θΜ·Γ±Κσ‘Ό’τΝσΘ§ΓΑΩ’Τχ¥Β≥ωΓΔSO2Έϋ ’ΓΔ―θΜ·Γ±ΒΡΙΐ≥Χ ΒΦ …œ «“ΜΗωBr2ΒΡ Ιΐ≥ΧΘ§”κ÷±Ϋ”’τΝσΚ§Br2ΒΡΚΘΥ°œύ±»”≈Βψ «œϊΚΡΗϋ…Ό≥…±ΨΫΒΒΆΚΆ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com