
| A. | C4H10的二氯取代物有4种 | |
| B. | 最简式为C2H5的烃结构简式有5种 | |
| C. | 乙苯的一氯取代物只有3种 | |
| D. | 分子式为C4H10O且与钠反应的有机物有4种 |
分析 A.丁烷有2种,然后分别写出二氯代物;
B.最简式为C2H5的烃为丁烷,有正丁烷、异丁烷2种同分异构体;
C.乙苯,苯环上有邻、间、对3种,乙基上有2种一氯代物;
D.丁基-C4H9可能的结构有4种,则与钠反应的C4H10O有4种.
解答 解:A.正丁烷有CH3CH2CH2CHCl2、CH3CH2CHClCH2Cl、CH3CHClCH2CH2Cl、CH2ClCH2CH2CH2Cl,CH3CCl2CH2CH3,CH3CHClCHClCH3.
异丁烷的一氯代物有2种:(CH3)2CHCH2Cl、(CH3)2CClCH3;
当一氯代物为(CH3)2CHCH2Cl时,二氯代物有3种:(CH3)2CHCHCl2、(CH3)2CClCH2Cl、CH3CH(CH2Cl)2;
当一氯代物为(CH3)2CClCH3时,二氯代物有1种:(CH3)2CClCH2Cl,与上面重复;
所以异丁烷的二氯代物的同分异构体共有3种,故A错误;
B.最简式为C2H5的烃为丁烷,有正丁烷、异丁烷2种同分异构体,故B错误;
C.乙苯,苯环上有邻、间、对3种,乙基上有2种一氯代物,共5种同分异构体,故C错误;
D.丁基-C4H9可能的结构有:-CH2CH2CH2CH3、-CH(CH3)CH2CH3、:-CH2CH(CH3)2、-C(CH3)3,则与钠反应的C4H10O有4种,故D正确.
故选D.
点评 本题考查同分异构体,题目难度不大,注意把握同分异构体概念的内涵与外延,需要注意的是同分异构体之间是不同的物质.


科目:高中化学 来源: 题型:解答题
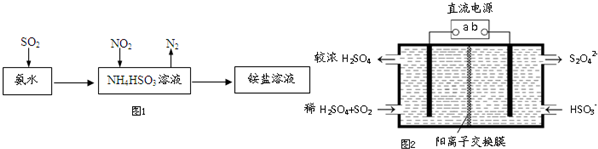
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1MgCl2溶液中的Mg2+数为nA | |
| B. | 1 mol Na2O2固体中含阴离子总数为2nA | |
| C. | 5 g质量分数为46%的乙醇溶液中,氢原子的总数为0.6 nA | |
| D. | 100 mL 12mol•L-1 浓盐酸与足量MnO2加热反应,转移电子数为1.2nA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲用于浓盐酸和漂粉精制取并收集干燥的Cl2 | |
| B. | 乙用于测定盐酸的浓度 | |
| C. | 丙用于证明浓硫酸具有脱水性和强氧化性 | |
| D. | 丁用于制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液 | |
| B. | 在加入铝粉能放出氢气的溶液中,K+、NH4+、CO32-、Cl-一定能够大量共存 | |
| C. | 氯化铝溶液中加入过量氨水反应的实质:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 依据铝热反应原理,能发生反应2Al+3MgO$\frac{\underline{\;高温\;}}{\;}$3Mg+A12O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com