

分析 (1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2中的Ce是+4价,在H2O2的作用下可生成Ce3+,因此发生还原反应,CeO2在该反应中作氧化剂;
(2)自然界中Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬,根据得失电子相等,Cr2O72-与SO32-的物质的量之比是1:3;结合原子守恒和电荷守恒配平书写离子方程式;
(3)工业上在550℃时用钠与四氯化钛反应可制得钛,四氯化钛被钠还原为钛,依据原子守恒书写;
(4)电镀废渣(除镍外,还含有铜、锌、铁等元素),加入稀硫酸,废渣部分溶解,过滤后滤液Ⅰ中含Cu2+、Zn2+、Fe2+、Ni2+,加入FeS通过沉淀转化生成硫化铜、硫化锌,除去Cu2+、Zn2+杂质,过滤得到滤液Ⅱ,滤液Ⅱ加H2O2是将Fe2+氧化Fe3+,然后调pH沉淀Fe3+,过滤后得到滤液Ⅲ,溶质的主要成分是NiSO4,加Na2CO3,NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4,经过蒸发浓缩、冷却结晶得到产品,据此分析解答.
解答 解:(1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2中的Ce是+4价,在H2O2的作用下可生成Ce3+,因此发生还原反应,CeO2在该反应中作氧化剂,
故答案为:氧化;
(2)自然界中Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬,根据得失电子相等,Cr2O72-与SO32-的物质的量之比是1:3;反应的离子方程式:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O,
故答案为:1,3,8H+,2,3,4;
(3)工业上在550℃时用钠与四氯化钛反应可制得钛,四氯化钛被钠还原为钛,反应的化学方程式为:4Na+TiCl4$\frac{\underline{\;550℃\;}}{\;}$Ti+4NaCl,
故答案为:4Na+TiCl4$\frac{\underline{\;550℃\;}}{\;}$Ti+4NaCl;
(4)电镀废渣(除镍外,还含有铜、锌、铁等元素),加入稀硫酸,废渣部分溶解,过滤后滤液Ⅰ中含Cu2+、Zn2+、Fe2+、Ni2+,加入FeS通过沉淀转化生成硫化铜、硫化锌,除去Cu2+、Zn2+杂质,过滤得到滤液Ⅱ,滤液Ⅱ加H2O2是将Fe2+氧化Fe3+,然后调pH沉淀Fe3+,过滤后得到滤液Ⅲ,溶质的主要成分是NiSO4,加Na2CO3,NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4,经过蒸发浓缩、冷却结晶得到产品.
①FeS除去Cu2+的反应是沉淀的转化,反应的离子方程式为:FeS+Cu2+=CuS+Fe2+,
故答案为:FeS+Cu2+=CuS+Fe2+;
②对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+,然后调pH使Fe3+完全沉淀,
故答案为:除去Fe3+;
③NiSO4与Na2CO3反应生成NiCO3沉淀,然后过滤,再加适量稀硫酸溶解又生成NiSO4,这样可提高NiSO4的浓度,有利于蒸发结晶,
故答案为:增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4);
④测定NiSO4•xH2O晶体中x的值,称取26.3g晶体加热至完全失去结晶水,剩余固体15.5g,失去水的质量=26.3g-15.5g=10.8g,NiSO4的质量为15.5g,计算物质的量得到1:x=$\frac{15.5g}{155g/mol}$:$\frac{10.8g}{18g/mol}$,解得x=6,
故答案为:6.
点评 本题考查了金属及其化合物性质及物质的分离和提纯的方法,题目难度中等,主要考查氧化还原反应的离子方程式书写方法和产物判断,注意掌握常见金属及其化合物性质,掌握基础是关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向某种化学肥料中加入熟石灰混合、研磨 | 没有氨味 | 该化学肥料一定不是氮肥 |
| B | 点燃某种纤维材料 | 无烧焦羽毛的气味 | 该纤维一定是合成纤维 |
| C | 向一未知溶液中加入稀盐酸 | 有无色气泡产生 | 该溶液中一定含有CO32- |
| D | 向一未知溶液中先滴加足量稀盐酸,再滴加BaC12溶液 | 先无现象,后产生白色沉淀 | 原溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
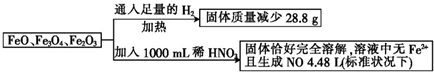
| A. | 4.0 mol•L-1 | B. | 4.4 mol•L-1 | C. | 4.8 mol•L-1 | D. | 3.6 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要是有气体参加或生成的化学反应,化学平衡都会受压强的影响 | |
| B. | 增大压强可以使气体分子数增多的可逆反应的正反应速率减小,逆反应速率增大,平衡逆向移动 | |
| C. | 减小压强可以使气体分子数减少的反应逆向移动,同时使正逆反应速率都减小 | |
| D. | 压强对反应前后气体分子数不变的反应的化学平衡和反应速率都没有影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
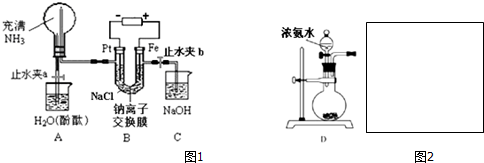
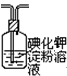 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子的未成对电子数在同周期元素中最多,W形成的单质是空气的主要成分之一,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子的未成对电子数在同周期元素中最多,W形成的单质是空气的主要成分之一,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
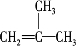 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质(括号中为杂质) | 除杂试剂 | 操作 |
| A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| B | 苯(苯酚) | 溴水 | 分液 |
| C | Fe2O3(Al2O3) | 氨水 | 过滤 |
| D | Cl2(HCl) | 饱和NaHCO3溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com