
 氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题:
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题:分析 I.Cl2溶于水生成少量HCl和HClO,具有酸性和漂白性;
Ⅱ.(1)氯气与NaOH反应生成NaCl、NaClO和水;
(2)由Cl2+2NaOH=NaCl+NaClO+H2O及物质的量计算解答;
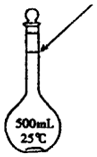
(3)①根据500mL4.0mol•L-1的NaOH溶液中含有的氢氧化钠的物质的量计算出质量,注意托盘天平准确度为0.1g;
②根据配制一定物质的量浓度的溶液的步骤:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀、装瓶等进行排序;
③配制溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀、装瓶等,结合步骤分析使用的仪器;
④根据俯视定容,导致加入的蒸馏水体积偏小进行判断对配制结果的影响;
⑤根据c=$\frac{n}{V}$可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化,若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
解答 解:Ⅰ.Cl2溶于水生成少量HCl和HClO,使溶液成酸性,紫色石蕊溶液遇酸变为红色,生成的HClO具有漂白性,可使石蕊褪色,则现象为溶液先变为红色,然后褪色,故答案为:溶液先变为红色,然后褪色;生成盐酸具有酸性、生成HClO具有漂白性;
Ⅱ.(1)氯气与NaOH反应生成NaCl、NaClO和水,该反应为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(2)n(Cl2)=$\frac{2.24L}{22.4L•mol{\;}^{-1}}$=0.1mol
由Cl2+2NaOH=NaCl+NaClO+H2O
知n(NaOH)=2n(Cl2)=2×0.1mol=0.2mol
V(NaOH溶液)=$\frac{0.2mol}{4.0mol•L{\;}^{-1}}$=0.05L,
故答案为:0.05;
(3)①n(NaOH)=0.5L×4.0mol•L-1=2.0mol,m(NaOH)=2.0mol×40g•mol-1=80.0g,故答案为:80.0g;
②配制溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀、装瓶等,则正确的顺序为a、b、d、c、f、e,故答案为:a、b、d、c、f、e;
③由上述实验步骤可知,需要的仪器为托盘天平、烧杯、玻璃棒、胶头滴管、500mL容量瓶、药匙,故答案为:托盘天平、烧杯、玻璃棒、胶头滴管、500mL容量瓶、药匙;
④定容时若俯视容量瓶刻度线,会导致加入的蒸馏水体积偏小,根据根据c=$\frac{n}{V}$可得,配制的溶液浓度偏高,
故答案为:偏高;
⑤A.容量瓶不干燥,含有少量蒸馏水,由于定容还需要加入蒸馏水,所以不影响配制结果,故A错误;
B.溶解所用的烧杯未洗涤,导致配制的溶液中溶质的物质的量偏小,根据c=$\frac{n}{V}$可得,配制的溶液浓度偏低,故B正确;
C.NaOH溶解后,未冷却即进行实验,则导致溶液的体积偏小,根据c=$\frac{n}{V}$可得,配制的溶液浓度偏高,故C错误;
D.定容后摇匀,发现液面低于刻度线,由于刻度线上方有残留的溶液,发现液面低于刻度线,然后又加水至刻度线,则导致溶液的体积偏大,根据c=$\frac{n}{V}$可得,配制的溶液浓度偏低,故D正确;
故选BD.
点评 本题考查氯气的性质及溶液的配制,把握发生的化学反应及溶液配制的步骤为解答的关键,注重基础知识的考查,题目难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
 垃圾的分类收集是实现垃圾处理无害化、减量化和资源化的重要措施.向贴有如图所示标志的垃圾箱中丢弃的垃圾应是( )
垃圾的分类收集是实现垃圾处理无害化、减量化和资源化的重要措施.向贴有如图所示标志的垃圾箱中丢弃的垃圾应是( )| A. | 厨房垃圾 | B. | 可回收垃圾 | C. | 有害垃圾 | D. | 其他垃圾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol氮气所含的分子数为NA个 | |
| B. | 在10℃时,1mol氮气所占体积大于22.4L | |
| C. | 常温常压下,28g氮气所占的体积大于22.4L | |
| D. | 标况下,以任意比混合的CO、CO2气体22.4L,所含分子总数为NA 个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn | B. | Fe | C. | Mg | D. | Al |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
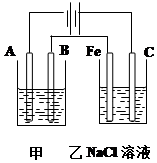 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
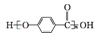 .
.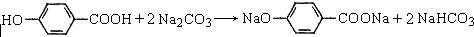 .
.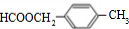 、
、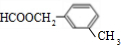 、
、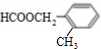 、
、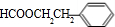 、
、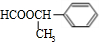 任一种.
任一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠加入醋酸溶液中:CO32-+2H+═H2O+CO2↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | Ba(OH)2加入过量NaHCO3溶液中:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| D. | 铜粉投入FeCl3溶液中:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 蒸发操作时,应将溶液完全蒸干后停止加热 | |
| B. | 稀释浓硫酸时,沿烧杯内壁将浓硫酸缓慢加入水中,边加边搅拌 | |
| C. | 分液操作时,先放出下层液体,再关闭活塞,从漏斗口倒出上层液体 | |
| D. | 配制一定物质的量浓度的溶液时,若加水超过容量瓶的刻度线,用胶头滴管吸出多余液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com