
| A. | 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>b>c | |
| B. | 常温下5.0×10-3mol/LKHA溶液的pH=3.75,该溶液中c(A2-)<c(H2A) | |
| C. | 室温时,M(OH)2(s)?M2+(aq)+2OH-(aq)Ksp=a; 当含M(OH)2固体的悬浊液中 c(M2+)=b mol/L时,溶液的pH等于14+$\frac{1}{2}1g(\frac{b}{a})$ | |
| D. | 图中a点溶液中各离子浓度的关系是: c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
分析 A.氢氧化钠溶液和氨水具有相同的pH,由于氢氧化钠是强电解质,则在稀释时强碱的变化程度大,加水稀释促进一水合氨电离;
B.常温下5.0×10-3mol/LKHA溶液的pH=3.75,说明HA-部分电离出氢离子,且HA-的电离程度大于其水解程度;
C.先根据该难溶物的溶度积及c(M2+)计算出该溶液中氢氧根离子浓度,然后根据c(H+)=$\frac{1×1{0}^{-14}}{c(O{H}^{-})}$及pH=-lgc(H+)计算出该溶液在常温下pH;
D.a点时,溶液中溶质为醋酸钠和氢氧化钠,根据电荷守恒和物料守恒分析.
解答 解:A.加水稀释氢氧化钠溶液和氨水中c(OH-)都变小,加水稀释促进一水合氨电离,则稀释后氨水的pH大于氢氧化钠,则a、b、c的大小关系是:a>c>b,故A错误;
B.常温下5.0×10-3mol/LKHA溶液的pH=3.75,说明HA-在溶液中部分电离出氢离子,且HA-的电离程度大于其水解程度,则c(A2-)>c(H2A),故B错误;
C.Ksp=c(M2+)×c2(OH-)=a,则c(OH-)=$\sqrt{\frac{a}{b}}$mol/L,常温下氢离子浓度为:c(H+)=$\frac{1×1{0}^{-14}}{c(O{H}^{-})}$,则该溶液的pH=-lgc(H+)=-lg$\frac{1×1{0}^{-14}}{c(O{H}^{-})}$=-lg$\frac{1{0}^{-14}}{\sqrt{\frac{a}{b}}}$=14+$\frac{1}{2}$lg($\frac{a}{b}$),故C错误;
D.a点时,溶液中溶质为等物质的量的醋酸钠和氢氧化钠,溶液中电荷守恒为:c(OH-)+c(CH3COO-)=c(H+)+c(Na+),物料守恒为:c(Na+)=2c(CH3COO-)+2c(CH3COOH),联立两个等式消去c(Na+)可得:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),故D正确.
故选D.
点评 本题考查了离子浓度大小比较、难溶物溶度积的计算,题目难度中等,注意掌握难溶物溶度积的概念及计算方法,明确溶液酸碱性与溶液的计算方法,能够根据电荷守恒、物料守恒、质子守恒、盐的水解原理判断溶液中各离子浓度大小.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成; 乙烯与水生成乙醇的反应 | |
| D. | 在苯中滴入溴水,溴水褪色;乙烯自身生成聚乙烯的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
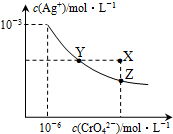 t℃时,AgCl的Ksp=2×10-10;Ag2CrO4是一种橙红色固体,在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
t℃时,AgCl的Ksp=2×10-10;Ag2CrO4是一种橙红色固体,在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | 在t℃时,AgCl的溶解度大于Ag2CrO4 | |
| B. | 在t℃时,Ag2CrO4的Ksp=1×10-12 | |
| C. | 在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点到X点 | |
| D. | 在t℃时,用AgNO3标准溶液滴定20mL未知浓度的KCl溶液,不能采用K2CrO4溶液为指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
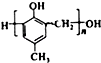 ,化合物C和化合物N的合成路线如下:
,化合物C和化合物N的合成路线如下: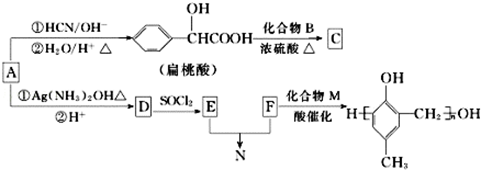
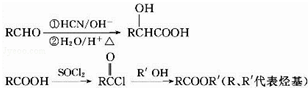
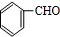 ,D的含氧官能团的名称是羧基.
,D的含氧官能团的名称是羧基.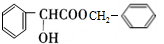 .
.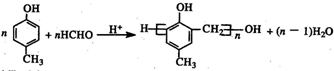 .
.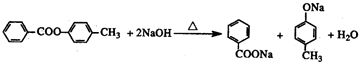 .
.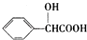 )有多种同分异构体.其中含有三个取代基,能与FeCl3溶液发生显色反应,也能与NaHCO3溶液反应放出气体的同分异构体共有10种,写出符合条件的三个取代基不相邻的一种同分异构体的结构简式
)有多种同分异构体.其中含有三个取代基,能与FeCl3溶液发生显色反应,也能与NaHCO3溶液反应放出气体的同分异构体共有10种,写出符合条件的三个取代基不相邻的一种同分异构体的结构简式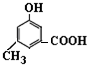 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | c(OH-)•c(H+) | ||
| C. | c (OH-) | D. | H+的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质、棉花、核酸、PVC、淀粉都是由高分子组成的物质 | |
| B. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| C. | 废弃的玻璃、金属、纸制品是可回收利用的资源 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④ | B. | ③>④>①>② | C. | ②>①④>>③ | D. | ④>③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
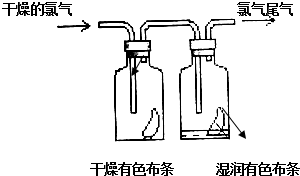 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量液溴、白磷和金属钠的保存均需用水封 | |
| B. | 容量瓶、滴定管在使用前均需用所装试剂润洗 | |
| C. | 苯和甲苯、乙醇和乙酸均可使用分液漏斗分离 | |
| D. | 除去氯化钠固体中的碘、除去碳酸钠固体中的碳酸氢钠,均可用加热的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com