
工业上用粉碎的煤矸石(主要含Al2O3、SiO2及铁的氧化物)制备净水剂BAC[Al2(OH)nCl6-n]的流程如下:

(1)粉碎煤矸石的目的是__________________________________________________;
滤渣Ⅰ的主要成分是________(填化学式)。
(2)步骤①在煮沸的过程中,溶液逐渐由无色变为绿色,此时溶液中的有色离子为_____
________(填化学式);随后溶液又变为棕黄色,相关反应的离子方程式为_________;步骤①的煮沸装置上方需安装一长导管,长导管的作用是__________________________。
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成BAC;二是________
_______________________;已知BAC的分散质粒子大小在1~100 nm之间,由此区别滤液Ⅰ与BAC两种液体的物理方法是________________________;若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,写出该反应的离子方程式: _______________________
(4)若0.1 mol AlCl3在某温度下溶于蒸馏水,当有5%水解生成Al(OH)3溶液时,吸收热量a kJ。写出该过程的热化学方程式:____________________________________。
(1)增大反应物接触面积,加快溶解速率(提高Al3+的浸出率) SiO2
(2)Fe2+ 4Fe2++O2+4H+=4Fe3++2H2O 冷凝、回流 (3)除去Fe3+ 用一束光照射液体,观察是否有丁达尔效应 Al3++4OH-=AlO2—+2H2O
(4)AlCl3(aq)+3H2O(l) Al(OH)3(aq)+3HCl(aq)ΔH=+200a kJ·mol-1
Al(OH)3(aq)+3HCl(aq)ΔH=+200a kJ·mol-1
【解析】(1)粉碎煤矸石能增大反应物的接触面积,加快反应速率;SiO2不溶于盐酸和硫酸,滤渣Ⅰ的主要成分是SiO2。(2)溶液中的Fe2+为绿色;Fe2+很容易被空气中的O2氧化成棕黄色的Fe3+,离子方程式为4Fe2++O2+4H+=4Fe3++2H2O;煮沸装置上方的长导管有冷凝、回流的作用。(3)步骤②中加入适量的Ca(OH)2并控制pH,使Fe3+生成Fe(OH)3,从而除去Fe3+;BAC的分散质粒子大小在1~100 nm之间,属于胶体,可以用丁达尔效应区别滤液Ⅰ与BAC两种液体;若Ca(OH)2溶液过量,部分Al3+生成AlO2—,离子方程式为Al3++4OH-=AlO2—+2H2O。
(4)根据题意:AlCl3 ~ ΔH
1 mol ΔH
0.1 mol×5% +a kJ·mol-1
则ΔH= =+200a kJ·smol-1,其热化学方程式为AlCl3(aq)+3H2O(l)
=+200a kJ·smol-1,其热化学方程式为AlCl3(aq)+3H2O(l) Al(OH)3(aq)+3HCl(aq) ΔH=+200a kJ·mol-1。
Al(OH)3(aq)+3HCl(aq) ΔH=+200a kJ·mol-1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题12化学实验基础练习卷(解析版) 题型:选择题
某学生做完实验以后,采取以下方法分别清洗所用仪器:①用浓氨水清洗做过银镜反应的试管;②用酒精清洗做过碘升华实验的烧杯;③用浓盐酸清洗做过KMnO4分解实验的试管;④用盐酸清洗长期存放过FeCl3溶液的试剂瓶;⑤用NaOH溶液清洗盛过苯酚的试管。你认为他的操作
( )。
A.①不对 B.③④不对C.④⑤不对 D.全部正确
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 综合实验设计练习卷(解析版) 题型:实验题
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的最佳物质的量之比为________ ;为了吸收该反应中产生的尾气,可选择的最佳装置是________(填序号)。

(2)为符合绿色化学的要求,某研究性学习小组进行如下 设计。
方案1:以空气为氧化剂。将铜粉在仪器N中反复灼烧,使铜与空气充分反应生成氧化铜,再使氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与烯硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,再通入空气或氧气,即发生反应,生成硫酸铜。反应完全后,加入物质甲调节pH,铁元素全部转化为Fe(OH)3沉淀(一般当铁离子的浓度下降到10-5mol·L-1时,就认为沉淀完全),然后过滤、浓缩、结晶。
(已知:常温下,Ksp[Cu(OH)2]=10-22,Ksp[Fe(OH)3]=10-38)
请回答下列问题:
①方案1中仪器N的名称是________。
②方案2中为了使铁元素全部沉淀,应调节pH至少为________。
③方案2中甲物质可选用________(填序号)。
A.CaO B.NaOH C.CuCO3 D.Cu2(OH)2CO3 E.Fe2(SO4)3
④方案2反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因:___________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 图像、图表练习卷(解析版) 题型:填空题
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。

(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)===IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq) HOI(aq) ΔH2
HOI(aq) ΔH2
③HOI(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3
总反应的化学方程式为_________________________________,其反应热ΔH=________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq) I3—(aq),其平衡常数表达式为________。
I3—(aq),其平衡常数表达式为________。
(3) 为探究Fe2+对O3氧化I-反应的影响(反应体系如上图),某研究小组测定两组实验中I3—浓度和体系pH,结果见下图和下表。
编号 | 反应物 | 反应前pH | 反应后pH |
第1组 | O3+I- | 5.2 | 11.0 |
第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
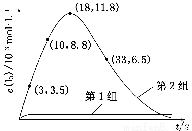
图2
①第1组实验中,导致反应后pH升高的原因是_____________________________
②图1中的A为________。由Fe3+生成A的过程能显著提高I-的转化率,原因是_____________________________________________
③第2组实验进行18 s后,I3—浓度下降。导致下降的直接原因有(双选)________。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图2,计算3~18 s内第2组实验中生成I3—的平均反应速率(写出计算过程,结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 化学工艺流程练习卷(解析版) 题型:填空题
上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)滤液X中含有的金属阳离子是______________(填离子符号)。
(2)步骤Ⅲ中可选用________调节溶液的pH(填字母)。
A.稀硫酸 B.氨水 C.氢氧化钠溶液 D.高锰酸钾溶液
(3)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是________________________________。
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是_____________________________________________。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(解析版) 题型:选择题
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1Na2SO4溶液,针对此过程的下列叙述正确的是 ( )

A.溶液中析出CaSO4沉淀,最终溶液中c(SO42—)较原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42—)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42—)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42—)较原来的大
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(解析版) 题型:选择题
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)ΔH=+489.0 kJ·mol-1①
CO(g)+ O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1②
O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1②
C(石墨)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1③
则4Fe(s)+3O2(g)=2Fe2O3(s)的ΔH为( )
A.+1 164.1 kJ·mol-1 B.-1 641.0 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 离子反应、氧化还原反应练习卷(解析版) 题型:填空题
某强酸性溶液X含有Ba2+、Al3+、N 、Fe2+、Fe3+、C
、Fe2+、Fe3+、C 、S
、S 、S
、S 、Cl-、N
、Cl-、N 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:

根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是 ;不能确定是否含有的离子是 ,若要确定其中阳离子的存在,最可靠的化学方法是 。
(2)沉淀G的化学式为 。
(3)写出有关离子方程式:
步骤①中生成A 。
步骤②生成沉淀I 。
(4)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明(1)中不能确定的阴离子存在的理由是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 物质结构与性质(选修3)练习卷(解析版) 题型:填空题
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: 。
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 。
共价键 | C—C | C—N | C—S |
键能/(kJ·mol-1) | 347 | 305 | 259 |
(2)C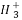 、—CH3(甲基)、C
、—CH3(甲基)、C 都是重要的有机反应中间体,有关它们的说法中正确的是( )
都是重要的有机反应中间体,有关它们的说法中正确的是( )
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.C 与NH3、H3O+互为等电子体,几何构型均为三角锥形
与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.C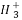 中的碳原子采取sp2杂化,所有原子均共面
中的碳原子采取sp2杂化,所有原子均共面
E.两个—CH3(甲基)或一个C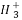 和一个C
和一个C 结合均可得到CH3CH3
结合均可得到CH3CH3
(3)金属阳离子含未成对电子越多,则磁性越强,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(4)某配合物的分子结构如下图所示,其分子内不含有 (填序号)。
A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com