
A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为 0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。 回答下列问题:
回答下列问题:
(1)E是 ;
(2)用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是 (填写序号) 。
a.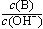 b.
b.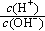 c.c(H+)·c(OH-) d.n(OH-)
c.c(H+)·c(OH-) d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是 (填写序号)
a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E
d.E溶液里有镁粉剩余
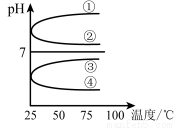
(4)将等体积、等物质的量浓度B和C混合后溶液, 升高温度(溶质不会分解)溶液pH随温度变化如右图中 曲线(填写序号) 。
升高温度(溶质不会分解)溶液pH随温度变化如右图中 曲线(填写序号) 。
(5)②中C与D溶液等体积混合后溶液呈酸性的原因 (用离子方程式表示);若室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为 。
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源:2016-2017学年江西省高二上学期期中化学试卷(解析版) 题型:选择题
下列物质在水溶液中的电离方程式书写正确的是( )
A.CH3COOH===H++CH3COO-
B.NaHSO4===Na++H++SO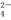
C.H3PO4 3H++PO
3H++PO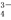
D.NaHCO3 Na++H++CO
Na++H++CO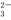
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上期中化学卷(解析版) 题型:选择题
I2在KI溶液中存在下列平衡:I2(aq)+I﹣(aq) I3﹣(aq),某I2、KI混合溶液中,c(I3﹣)与温度T的关系如图所示
I3﹣(aq),某I2、KI混合溶液中,c(I3﹣)与温度T的关系如图所示 (曲线上任何一点都表示平衡状态)。下列说法正确的是( )
(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
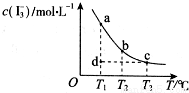
A.反应 I2(aq)+I﹣(aq) I3﹣(aq)△H>0
I3﹣(aq)△H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K2>K1
C.若T1时,反应进行到状态d时,一定有υ正>υ逆
D.状态a与状态b相比,状态b时I2的转化率更高
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省南阳市高一上学期期中化学试卷(解析版) 题型:选择题
把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含m mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含nmol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡,则原混合溶液中钾离子的物质的量浓度为( )
A.(4n-2m)/V mol·L-1 B.(n-2m))/V mol·L-1
C.(2n-2m)/ V moI·L-1 D.(n-m)/V mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省南阳市高一上学期期中化学试卷(解析版) 题型:选择题
用Na表示阿伏加德罗常数,下列说法中正确的有( )
A.标准状况下,lmolH2O的体积约为22.4L
B.常温常压下,17g NH3含氢原子数目为3Na
C.1mol/L的CaCl2溶液中含CI-的数目为2Na
D.标准状况下,2.24 LCl2制成的氯水中含有0.lNa个Cl2分子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上调研三化学卷(解析版) 题型:选择题
有①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液各25 mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是( )。
A.三种溶液pH的大小顺序是③>②>①
B.若将三种溶液稀释相同倍数,pH变化最大的是②
C.若 分别加入25 mL 0.1 mol·L-1盐酸后,pH最大的是①
分别加入25 mL 0.1 mol·L-1盐酸后,pH最大的是①
D.若三种溶液的pH均为9,则物质的量浓度的大小顺序③>①>②
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上调研三化学卷(解析版) 题型:选择题
在25 ℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是( )
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三12月月考化学试卷(解析版) 题型:实验题
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:

已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++TiOCl +2H2O。
+2H2O。
(1)若在实验室中煅烧固体混合物,会用到多种硅酸盐质的仪器,除玻璃棒 、酒精灯、泥三角外,还有________(填仪器名称)。流程中多次涉及沉淀,则洗涤沉淀的方法是 。
、酒精灯、泥三角外,还有________(填仪器名称)。流程中多次涉及沉淀,则洗涤沉淀的方法是 。
(2)生产中利用滤渣A制备半导体的反应方程式是_________________。
(3)滤液B中TiOCl 转化生成TiO2的离子方程式是____________________。
转化生成TiO2的离子方程式是____________________。
(4)反应②中固体TiO2转化成(NH4)2Ti5O1 5溶液时,Ti元素的浸出率与反应温度有关,反应温度过高时,Ti元素浸出率会下降,其原因是__________ ____。
5溶液时,Ti元素的浸出率与反应温度有关,反应温度过高时,Ti元素浸出率会下降,其原因是__________ ____。
(5)由滤液D制备LiFePO4的过程中,所需双氧水与H2C2O4的物质的量比是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com