
【题目】下列离子方程式中,书写错误的是( )
A.碳酸钠溶液跟稀硫酸混合: CO32﹣+2H+=H2O+CO2↑
B.硝酸铜溶液中滴加烧碱溶液: Cu2++2OH-=Cu(OH)2↓
C.将CO2通入足量的氢氧化钠溶液中: 2OH-+CO2=CO32﹣+H2O
D.硫酸溶液中加入Ba(OH)2溶液: Ba2++ SO![]() -=BaSO4↓
-=BaSO4↓
科目:高中化学 来源: 题型:
【题目】生活中处处有化学,下列有关说法正确的是
A.天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子
B.焊接时用NH4Cl溶液除锈与盐类水解无关
C.生活中用电解食盐水的方法制取消毒液,运用了盐类的水解原理
D.在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液,溶液的红色逐渐褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 mol·Lˉ1的NaOH溶液和氨水,下列说法正确的是
A. c(NH3H2O) + c(NH4+) = c(Na+)
B. NH3的水溶液能导电,所以NH3是电解质
C. 氨水的pH大于NaOH溶液
D. 将浓度为0.1 mol·Lˉ1的盐酸和氨水等体积混合后,所得溶液中:c(OH-) > c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了科学饮食,了解一些与食品相关的化学知识是必要的。
(1)油炸虾条、薯片等容易挤碎的食品,不宜选用真空袋装,而应采用充气袋装。下列气体中不应该充入的是________(填序号,下同)。
A.氮气 B.二氧化碳
C.空气 D.氧气
(2)为使以面粉为原料的面包松软可口,通常用碳酸氢钠作发泡剂,因为它________。
A.热稳定性差 B.增加甜味
C.产生二氧化碳 D.提供钠离子
(3)能直接鉴别氯化钠和葡萄糖两种未知浓度溶液的方法是________。
A.观察颜色 B.测量比值
C.加热灼烧 D.分别闻味
(4)苯甲酸钠是常用的食品防腐剂,其结构简式如图。以下对苯甲酸钠描述错误的是________。

A.属于盐类 B.能溶于水
C.属于烃类 D.不易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁![]() 是一种补铁强化剂广泛用于缺铁性贫血的预防和治疗。某学习小组欲利用硫酸亚铁溶液与甘氨酸反应制备甘氨酸亚铁,有关物质性质如表:
是一种补铁强化剂广泛用于缺铁性贫血的预防和治疗。某学习小组欲利用硫酸亚铁溶液与甘氨酸反应制备甘氨酸亚铁,有关物质性质如表:
甘氨酸( | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程
实验1制备![]() :将含
:将含![]() 的溶液与
的溶液与![]() 溶液混合,反应结束后过滤并洗涤沉淀。
溶液混合,反应结束后过滤并洗涤沉淀。
实验2制备![]() :
:
实验装置如图(夹持和加热仪器已省略),将实验1得到的沉淀和含![]() 甘氨酸的水溶液混合后加入
甘氨酸的水溶液混合后加入![]() 中。利用
中。利用![]() 中的反应将
中的反应将![]() 中空气排净,接着滴入柠檬酸溶液并加热。
中空气排净,接着滴入柠檬酸溶液并加热。
实验3提纯![]() :反应结束后过,将滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品。
:反应结束后过,将滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品。
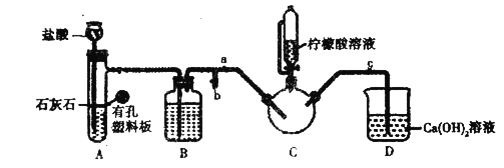
(1)写出实验1中制备![]() 的离子方程式_________________。
的离子方程式_________________。
(2)装盐酸的仪器名称是__________,装置![]() 中的试剂是__________。
中的试剂是__________。
(3)实验2中,打开![]() 关闭
关闭![]() ,排尽空气。确认
,排尽空气。确认![]() 中空气排尽的实验现象是________________,排尽空气后进行的实验操作是________,接着滴入柠檬酸溶液并加热。
中空气排尽的实验现象是________________,排尽空气后进行的实验操作是________,接着滴入柠檬酸溶液并加热。
(4)实验2中的柠酸可调节溶液![]() ,体系
,体系![]() 与产率的关系如表
与产率的关系如表
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
体系 | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 |
产率(%) | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 |
![]() 过低产率下降的原因是________________________;柠檬酸的作用还有_______。
过低产率下降的原因是________________________;柠檬酸的作用还有_______。
(5)实验3中加入乙醇的目的是____________________。
(6)若产品的质量为![]() ,则产率为__________________%。
,则产率为__________________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与![]() 的变化关系
的变化关系
C. 当混合溶液呈中性时,![]()
D. NaHX溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A. 表示硫的燃烧热的热化学方程式S(s)+![]() O2(g)=SO3(g);ΔH=-315 kJ·mol-1
O2(g)=SO3(g);ΔH=-315 kJ·mol-1
B. 表示中和热的热化学方程式NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.3 kJ·mol-1
C. 表示H2燃烧热的热化学方程式H2(g)+![]() O2(g)=H2O(g);ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g);ΔH=-241.8 kJ·mol-1
D. 表示CO燃烧热的热化学方程式2CO(g)+O2(g)=2CO2(g);ΔH=-566 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-801.3kJ/mol 结论:CH4的燃烧热为801.3kJ/mol
B. Sn(s,灰) ![]() Sn(s,白) ΔH=+2.1kJ/mol(灰锡为粉末状)结论:锡制品在寒冷的冬天因易转化为灰锡而损坏
Sn(s,白) ΔH=+2.1kJ/mol(灰锡为粉末状)结论:锡制品在寒冷的冬天因易转化为灰锡而损坏
C. 稀溶液中有:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol结论:将盐酸与氨水的稀溶液混合后,若生成1mol H2O,则会放出57.3kJ的能量
D. C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1C(s,金刚石)+O2(g)=CO2(g) ΔH=-395kJ·mol-1 结论:相同条件下金刚石性质比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:


①第一步反应是______________(填“放热”或“吸热”)反应,判断依据是___________。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________。
(2)已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1;4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1________ΔH2(填“>”、“<”或“=”)。
(3)在298 K、101 kPa时,已知:①2H2O(g)=O2(g)+2H2(g) ΔH1;②Cl2(g)+H2(g)=2HCl(g) ΔH2;③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3,则ΔH3与ΔH1和ΔH2之间的关系正确的是________。
A.ΔH3=ΔH1+2ΔH2
B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2
D.ΔH3=ΔH1-ΔH2
(4)已知:
①2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1②Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g) ΔH=-226 kJ·mol-1,则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为_____________。
O2(g) ΔH=-226 kJ·mol-1,则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为_____________。
(5)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:

则表中a=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com