
����Ŀ����������ijЩ����Ԫ���ڹ�ҵ���������ż�����Ҫ�����á�
��1������Cr������Ϊ������ֵ����Ӽ�����
��д��Cr�����ڱ��е�λ��______��
����ԭ�Ӻ�������Ų�������ܲ������______��
����lmolCrO5������ CrΪ+6�ۣ��У����й���������ĿΪ______��
��2������V�����ҹ��ķ��Ԫ�أ�����Ϊ����ҵ��ζ�������㷺���ڴ���������ҵ���ش��������⣺
��д����̬��ԭ�ӵļ۵����Ų�ͼ��______��
��V2O5������SO2ת��ΪSO3�Ĵ�����SO3�������廷״�ṹ��ͼ1��ʾ���ýṹ��Sԭ�ӵ��ӻ��������Ϊ______��
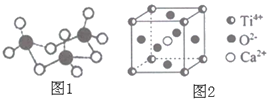
��3������Ni����һ���������л���Ӧ������Ni����CO�γ����������ε������ Ni��CO��4��������ԭ����______����Ԫ�ط��ţ���
��4���ѣ�Ti������Ϊ��21���ͽ����������ѿ�CaTiO3�������ǹ�ҵ��ȡ�ѵ���Ҫԭ�ϣ��侧���ṹ��ͼ2����������Ϊa=0.266 nm�������� Ti��Ca��O�ֱ��ڶ��ǡ����ġ�����λ�á�
��Ti��O֮�����̾���Ϊ______nm��
����Ti���ڵ�O����Ϊ______��
���𰸡��������ڵ�VIB�� N 2NA ![]() sp3 C 0.188 12
sp3 C 0.188 12
��������
�Ţ�Cr��24��Ԫ�أ�λ�ڵ������ڵ�VIB�壻�ڻ�̬ԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d54s1����ԭ�Ӻ�������Ų�������ܲ��ǵ��ĵ��Ӳ㣻��CrO5��5��O��Ϊ-6�ۣ��ض���4��Ϊ-1�ۣ�CrO5���ӽṹʽΪ![]() ��
��
�Ƣٷ�ԭ�Ӽ۵����Ų�ʽΪ3d34s2���������ԭ�������ع����۵����Ų�ͼ���ڸ÷�����Sԭ�Ӽ۲���ӶԸ�����4�Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж�Sԭ���ӻ����͡�
��Cԭ����Oԭ�Ӿ�����1�Թ¶Ե��ӣ��縺��ԽǿԽ�����ṩ�¶Ե��ӣ�
�Ȣ�Ti��O֮�����̾���Ϊ������Խ��߳��ȵ�һ�룻����Ti���ڵ�O����=3��8��2��
�Ţ�Cr��24��Ԫ�أ�λ�ڵ������ڵ�VIB�壻�ʴ�Ϊ���������ڵ�VIB�塣
�ڻ�̬ԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d54s1����ԭ�Ӻ�������Ų�������ܲ��ǵ��ĵ��Ӳ㣬�ò����ΪN���ʴ�Ϊ��N��
��CrO5��5��O��Ϊ-6�ۣ��ض���4��Ϊ-1�ۣ�CrO5���ӽṹʽΪ![]() ��������������������1mol CrO5���й���������ĿΪ2NA���ʴ�Ϊ��2NA��
��������������������1mol CrO5���й���������ĿΪ2NA���ʴ�Ϊ��2NA��
�Ƣٷ�ԭ�Ӽ۵����Ų�ʽΪ3d34s2���۵����Ų�ͼΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��SO3�������壨SO3��3�Ļ�״�ṹ��Sԭ���γ�4���������ӻ������ĿΪ4��Sԭ�Ӳ�ȡsp3�ӻ����ʴ�Ϊ��sp3��
��Cԭ����Oԭ�Ӿ�����1�Թ¶Ե��ӣ�O�ĵ縺�Ա�C��ǿ��Oԭ�Ӳ����ṩ�¶Ե��ӣ�Cԭ���ṩ�¶Ե��ӣ���Ni(CO)4����ԭ����C���ʴ�Ϊ��C��
�Ȣ�Ti��O֮�����̾���Ϊ������Խ��߳��ȵ�һ��![]() ���ʴ�Ϊ��0.188��
���ʴ�Ϊ��0.188��
����Ti���ڵ�O����=3��8��2=12;�ʴ�Ϊ��12��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������X�ķ���ʽΪC5H11Cl����NaOH�Ĵ���Һ����X���ɵ÷���ʽΪC5H10�����ֲ���Y��Z��Y��Z��������ɵõ�2�����顣����������X��NaOH��ˮ��Һ�������������л�����Ľṹ��ʽ�������� ��
A��CH3CH2CH2CH2CH2OH B����CH3��2COHCH2CH3
C����CH3��2CHCH2CH2OH D����CH3��3CCH2OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦX(g)+3Y(g)![]() 2Z(g) ��H�������仯����ͼ��ʾ������˵����ȷ����
2Z(g) ��H�������仯����ͼ��ʾ������˵����ȷ����
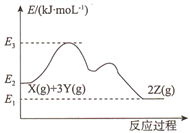
A. ��H= E2- E1 B. ����������,E3����
C. ��ѹ�³���һ�����ĺ���n(Z)���� D. ѹ��������c(X)��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ���壬�����ܱ������еķ�Ӧ��![]()
(1)д���÷�Ӧ���淴Ӧ�Ļ�ѧƽ�ⳣ������ʽ______�������¶ȣ��÷�Ӧ��ѧ��Ӧ����______��������ת����______![]() ���Ͼ�����������������С������������
���Ͼ�����������������С������������![]() ��ʵ���������¶�һ�������
��ʵ���������¶�һ�������![]() ��ԭ����______��
��ԭ����______��
(2)�ܱ�ʾ�÷�Ӧ�ں��º����ܱ�������![]() ʱ�̺��Ѿ��ﵽƽ��״̬��ͼʾ��______��
ʱ�̺��Ѿ��ﵽƽ��״̬��ͼʾ��______��
(3)Ũ��![]() �İ�ˮ��pHΪ
�İ�ˮ��pHΪ![]() ��������ˮϡ��100��ʱ����
��������ˮϡ��100��ʱ����![]() �ĵ���ƽ�⽫��______�����ƶ�
�ĵ���ƽ�⽫��______�����ƶ�![]() ����������������
����������������![]() ����Һ��pH��Ϊ______
����Һ��pH��Ϊ______![]() ����������С������������
����������������������![]() ��
��
���һ����ʵ�飬֤��һˮ�ϰ������______��
ij��ѧ��ȤС����������й����Ȼ�淋Ŀ���ʵ�飺
��ʵ�������
![]()
�����Ȼ�����Һ�IJ����ܿ��չ⣬�����Ȼ����Һ�IJ�����ȼ�գ�ð�����̡�
(4)�Ȼ�隣�����Һ������Ũ���ɴ�С��˳����______�����̵ijɷ���______��
(5)���Ʋ�����Ȼ����Һ�IJ�����ȼ�ա������Ż����Ҫԭ��![]() д��һ������
д��һ������![]() ______
______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���100 mL 0.01 molL��1 HA��Һ����μ���0.02 molL��1��MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�仯���������˵������ȷ����

A. HAΪһԪǿ�ᣬMOHΪһԪ����
B. N����Һ������Ũ�ȴ�С��ϵΪ��c��M+��=c��A������c��H+��=c��OH����
C. N��ˮ�ĵ���̶ȴ���K��ˮ�ĵ���̶�
D. N��K֮������������һ�㶼��c��M+�� ��c��OH������c��A������c��H+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������F���ĺϳ�·����ͼ��
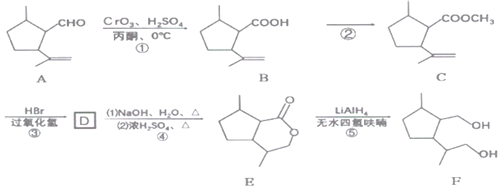
�ش��������⣺
��1��E�����������______��
��2��̼ԭ��������4����ͬ��ԭ�ӻ���ţ���̼��Ϊ����̼����C�е�����̼ԭ����______����
��3����Ӧ�ٵķ�Ӧ������______��
��4��д����Ӧ�ڵĻ�ѧ��Ӧ����ʽ______��
��5��д��D�Ľṹ��ʽ______��
��6����֪�����廯����G��B��������ԭ�ӣ�G�ĺ˴Ź���������ͼ2����G���ܵĽṹ��ʽΪ______��
��7�������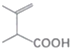 �Ʊ�
�Ʊ� �ĺϳ�·�ߡ�______�����Լ���ѡ��
�ĺϳ�·�ߡ�______�����Լ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̼�IJ�����������ʵ������������ŵ���Ҫ;��֮һ��
��1��Ŀǰ��ҵ���õIJ�̼��NH3��(NH4)2CO3��������CO2�������¿��淴Ӧ��
2NH3(l)+H2O(l)+CO2(g)![]() (NH4)2CO3(aq) ��H1
(NH4)2CO3(aq) ��H1
NH3(l)+H2O(l)+CO2(g)![]() NH4HCO3(aq) ��H2
NH4HCO3(aq) ��H2
(NH4)2CO3(aq)+H2O(l)+CO2(g)![]() 2NH4HCO3(aq) ��H3
2NH4HCO3(aq) ��H3
����H3=______________���ú���H1����H2�Ĵ���ʽ��ʾ��
��2������CO2�Ʊ���ϩ���ҹ���Դ�����һ����Ҫս�Է��������£�
����һ��CO2������ϳ���ϩ���䷴ӦΪ��
2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ��H=a kJ��mol-1
C2H4(g)+4H2O(g) ��H=a kJ��mol-1
��ʼʱ��n(CO2)��n(H2)=1��3��Ͷ�ϱȳ���20L�ĺ����ܱ������У���ͬ�¶���ƽ��ʱ��H2��H2O�����ʵ�����ͼ����ʾ��
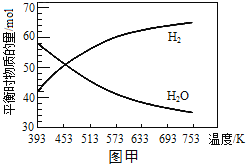
������˵����ȷ����________��
A���÷�Ӧ����Ӧ�Ļ��С���淴Ӧ�Ļ��
B��������������ʱ����ѹ�������ݻ��������Ӱٷ�������v����v��������
C����������ڻ������ƽ������������ʱ��ı�ʱ��˵����Ӧ�Ѵﵽƽ��
D��ʹ�ú��ʵĴ����������ı䷴Ӧ���̣���С��Ӧ�ʱ䣬�ӿ췴Ӧ����
��393K�£�H2��ƽ��ת����Ϊ__________��������λ��Ч���֣���
��393K�£��÷�Ӧ�ﵽƽ������������а�n(CO2)��n(H2)=1��3Ͷ��CO2��H2��n(H2)/n(C2H4)��__________�������䡱��С������ȷ��������
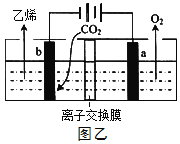
���������ö��Ե缫���ǿ���ԵĶ�����̼ˮ��Һ�ɵõ���ϩ����ԭ����ͼ����ʾ��
��b�缫�ϵĵ缫��ӦʽΪ_________________________��
�ݸ�װ����ʹ�õ���_________________������������������ӽ���Ĥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)H2A��ˮ�д�������ƽ�⣺H2A![]() H����HA����HA��
H����HA����HA��![]() H����A2����NaHA��Һ�����ԣ�����Һ������Ũ�ȵĴ�С˳��Ϊ__________________________��
H����A2����NaHA��Һ�����ԣ�����Һ������Ũ�ȵĴ�С˳��Ϊ__________________________��
(2)��֪������H2A�ĸ���(CaA)������Һ�д�������ƽ�⣺CaA(s)![]() Ca2��(aq)��A2��(aq)�μ�����Na2A���壬c(Ca2��)___(�������С�����䡱)��ԭ����______��
Ca2��(aq)��A2��(aq)�μ�����Na2A���壬c(Ca2��)___(�������С�����䡱)��ԭ����______��
(3)����![]() �ķ�ˮ���Խϴ�ij������ˮ�к�4.00��10��3 mol��L��1��Cr2O
�ķ�ˮ���Խϴ�ij������ˮ�к�4.00��10��3 mol��L��1��Cr2O![]() ��Ϊʹ��ˮ�ܴ���ŷţ������´�����
��Ϊʹ��ˮ�ܴ���ŷţ������´�����![]()
![]() Cr2����Fe3��
Cr2����Fe3��![]() Cr(OH)3��Fe(OH)3��
Cr(OH)3��Fe(OH)3��
�ٸ÷�ˮ�м���FeSO4��7H2O��ϡ���ᣬ������Ӧ�����ӷ���ʽΪ��_______��
����������ķ�ˮ�в�����c(Fe3��)��1��10��13 mol��L��1���������Cr3����Ũ��Ϊ__________________��{��֪��Ksp[Fe(OH)3]��1.0��10��38 ��Ksp[Cr(OH)3]��1.0��10��31}
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ⶨijNaOH��Һ�����ʵ���Ũ�ȣ�����0.100 0 mol��L��1��HCl����Һ�ζ������(�ü�����ָʾ��)����ش��������⣺
��1���ζ�ʱ��ʢװ����NaOH��Һ����������Ϊ________��
��2���ζ����յ����ɫ�仯Ϊ____________��
��3������ѧ����ʵ���������������ƽ��ʵ�飬���ݼ�¼���£����ʱ���ı���Һ�����Ϊ__________�����������NaOH��Һ�����ʵ���Ũ��Ϊ______��(������λ��Ч����)
ʵ�� ��� | ����NaOH��Һ�����/mL | 0.100 0 mol��L��1 HCl��Һ�����/mL | |
�ζ�ǰ�̶� | �ζ���̶� | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.00 | 31.00 |
3 | 25.00 | 1.00 | 27.31 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com