
| 编号 | A的分子式 | B的分子式 | VA:VB |
| ① | C4H10 | C3H6 | 3:2 |
| ② | C4H10 | C2H4 | 4:1 |
| ③ | C4H10 | C2H2 | 4:1 |
| ④ | C4H10 | C3H4 | 3:2 |
分析 (1)根据体积之比等于物质的量之比,由混合气体1L充分燃烧后得到同温同压下3.6LCO2,可知混合气体的平均分子式为C3.6Hx,然后根据要想碳原子的平均值为3.6,必须有一种烃的碳原子数小于3.6,另一种烃的碳原子数大于3.6,且碳原子数若>4,那么常温下不是气体,故一种烃中最多为4个碳,据此讨论即可;
(2)根据烃的燃烧规律:CxHy+(x+$\frac{1}{4}$y)O2$\frac{\underline{\;点燃\;}}{\;}$CO2+$\frac{1}{2}$yH2O(气),结合气体体积差量法计算平均氢原子数,得到气体的组成即可.
解答 解:(1)因1升混合气体充分燃烧后生成3.6升CO2,且A分子的碳原子数比B分子的多,混合气体只能由碳原子数大于3.6的烷烃(C4H10)和碳原子数小于3.6的烯烃或炔烃(C3H6和C2H4、C3H4和C2H2)组成.它们有四种可能的组合:C4H10、C3H6;C4H10、C2H4;C4H10、C3H4;C4H10、C2H2;根据每一种组合中烷烃和烯烃的碳原子数及燃烧后生成的CO2体积,可确定A和B的体积比,如: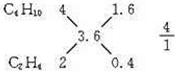 ,则V(C4H10):V(C2H4)=4:1,C4H10;C3H6=3:2;②C4H10:C2H2=4:1;C4H10:C3H4=3:2,
,则V(C4H10):V(C2H4)=4:1,C4H10;C3H6=3:2;②C4H10:C2H2=4:1;C4H10:C3H4=3:2,
故答案为:①C4H10、C3H6、3:2;②C4H10、C2H4、4:1③C4H10、C2H2、4:1④C4H10、C3H4、3:2;
(2)设1升气态烃与氧充分燃烧后体积变化为△V升,则:
CxHy+(x+$\frac{1}{4}$y)O2$\frac{\underline{\;点燃\;}}{\;}$CO2+$\frac{1}{2}$yH2O(气)△V
1 x+$\frac{1}{4}$y 1 $\frac{1}{2}$y $\frac{1}{4}$y-1
2L 2L
$\frac{1}{\frac{1}{2}}$=$\frac{\frac{y}{4}-1}{2}$,解y=8,平均分子式中H原子为8个,故组合①符合题意,即A:C4H10;B:C3H6,答:A和B的分子式分别为:A:C4H10;B:C3H6.
点评 本题主要考查了十字交叉法、差量法的使用,有一定的难度,注意根据燃烧的方程式进行判断.


科目:高中化学 来源: 题型:解答题
 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.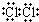 .新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是漂白粉比次氯酸稳定,便于储存和运输,漂白粉是一种混合物(填“混合物”或“纯净物”)
.新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是漂白粉比次氯酸稳定,便于储存和运输,漂白粉是一种混合物(填“混合物”或“纯净物”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钠的化合物在生产生活中应用广泛.
钠的化合物在生产生活中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6与C4H10一定互为同系物 | |
| B. | C2H4与C4H8一定互为同系物 | |
| C. | 分子量相同的两种物质一定互为同分异构体 | |
| D. | 分子中含有羟基的物质一定是醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫原子的原子结构示意图: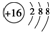 | |
| B. | 氚原子可表示为${\;}_{1}^{2}$H | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 铁位于周期表第4周期第ⅧB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中转移3个电子 | B. | Fe2O3发生还原反应 | ||
| C. | CO被还原 | D. | CO为氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 79、81 | B. | 45、46 | C. | 44、45 | D. | 44、46 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com