
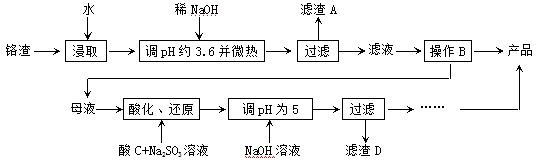
 Cr2O72����H2O���ͼʾװ�ã���Ϊ���Ե缫�����Na2CrO4��Һ��ȡNa2Cr2O7��ͼ���Ҳ�缫���ӵ�Դ�� ������缫��ӦʽΪ ��
Cr2O72����H2O���ͼʾװ�ã���Ϊ���Ե缫�����Na2CrO4��Һ��ȡNa2Cr2O7��ͼ���Ҳ�缫���ӵ�Դ�� ������缫��ӦʽΪ ��


 ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ��Ӧ2SO2��g��+O2��g�� 2SO3��g���ġ�H= kJ��mol-l��ʹ��V2O5��������÷�Ӧ�淴Ӧ�Ļ�� ������������䡱��С������
��Ӧ2SO2��g��+O2��g�� 2SO3��g���ġ�H= kJ��mol-l��ʹ��V2O5��������÷�Ӧ�淴Ӧ�Ļ�� ������������䡱��С������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
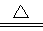 LiNH2+2LiH����������Ϊ ���ѧʽ������270��ʱ���÷�Ӧ���������ų�H2���������﮿���Ϊ������ϣ������������ɴ�Li3N������ %����ȷ��0.1����
LiNH2+2LiH����������Ϊ ���ѧʽ������270��ʱ���÷�Ӧ���������ų�H2���������﮿���Ϊ������ϣ������������ɴ�Li3N������ %����ȷ��0.1���� FePO4֮���ת������طŵ�ʱ���������ķ�ӦΪLiXC6��Xe��
FePO4֮���ת������طŵ�ʱ���������ķ�ӦΪLiXC6��Xe�� XLi++6C��д����طŵ�ʱ�ĵ缫��Ӧ�Ļ�ѧ����ʽ ��
XLi++6C��д����طŵ�ʱ�ĵ缫��Ӧ�Ļ�ѧ����ʽ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
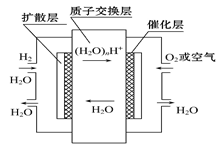
| A������ͨ��H2��������ԭ��Ӧ |
| B������ͨ��H2��������ԭ��Ӧ |
| C����������Ϊ���ӣ����ڵ���ڲ��������������� |
| D���ܷ�ӦʽΪ2H2+O2 = 2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���

 (aq)
(aq) PbCO3(s)��SO42-(aq)
PbCO3(s)��SO42-(aq) )��c(SO42-)
)��c(SO42-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
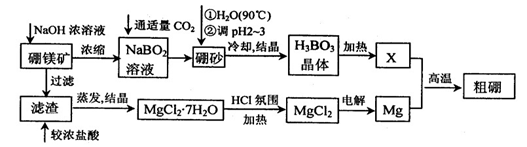
 10-12������ҺpH=6ʱ (��С���û�С�)Mg(OH)2����������
10-12������ҺpH=6ʱ (��С���û�С�)Mg(OH)2�����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
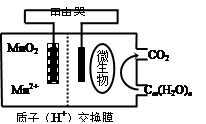
| A���������ΪCm(H2O)n������һ�������� |
| B���������ڵ缫���ŵ�ʱ������ԭ��Ӧ |
| C���ŵ�����У�H���������������� |
| D��������ӦʽΪ��MnO2��4H+��2e��=Mn2����2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����ʱ���������Һ�е�H+���ƶ� |
| B������0.4mol����ת�ƣ����ڱ�״��������4.48L���� |
| C����ط�Ӧ�Ļ�ѧ����ʽΪ��CH3CH2OH + O2 = CH3COOH + H2O |
| D�������Ϸ����ķ�ӦΪ��O2 + 4e��+ 2H2O = 4OH�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
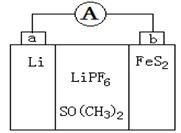
| A����װ�ý���ѧ��ת��Ϊ���� |
| B�������ƶ���������a����b�� |
| C��������ˮ����SO(CH3)2���ܼ� |
| D��b����Ӧʽ��FeS2��4Li+��4e-��Fe��2Li2S |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com