
A、用数轴表示分散系的分类: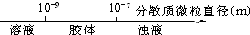 |
| B、已知氯酸钾与蔗糖(C12H22O11)反应的产物为KCl、CO2和水,则氧化产物与还原产物的物质的量之比为2:3 |
| C、10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49% |
| D、可以用Ba(OH)2和焰色反应鉴别NaHCO3、NaCl、KCl、K2SO4 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4℃时,5.4mL水中所含的水分子数是0.3NA(4℃时,水的密度为1.0g/ml) |
| B、在常温常压下,11.2L氯气所含的原子数为NA |
| C、标准状况下,22.4L氢气所含的质子数为2 NA |
| D、2L 1mol?L-1K2SO4溶液中离子的总数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
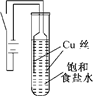 某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:| 序号 | 操作 | 现象 |
| ① | 滴入稀硝酸溶液 | 沉淀溶解,有无色气泡产生,最终得到蓝色溶液 |
| ② | 滴入稀硫酸溶液 | 橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
| 物质 | 颜色 | 物质 | 颜色 |
| 氯化铜 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 氢氧化亚铜(不稳定) | 橙黄色 |
| 碱式氯化铜 | 绿色 | 氢氧化铜 | 蓝色 |
| 氧化亚铜 | 砖红色或橙黄色 | 氯化亚铜 | 白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com