
分析 钡离子恰好完全反应时,氢氧化钡与硫酸铝钾的物质的量之比为2:1,铝离子恰好完全反应生成偏铝酸根离子;继续滴加明矾溶液,铝离子与偏铝酸根离子发生双水解反应生成氢氧化铝沉淀,以此来解答.
解答 解:向Ba(OH)2溶液中,逐滴加入明矾溶液至Ba2+恰好完全沉淀,铝离子完全反应生成偏铝酸根离子,反应的离子方程式为Al3++2SO42-+4OH-+2Ba2+═2BaSO4↓+AlO2-+2H2O;若继续滴加明矾,铝离子会与偏铝酸根离子发生双水解反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++2SO42-+4OH-+2Ba2+═2BaSO4↓+AlO2-+2H2O;Al3++3AlO2-+6H2O=4Al(OH)3↓.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 以金属银为阳极电解饱和NaCl溶液:2Cl-+2H2O=H2↑+Cl2↑+2OH- | |
| B. | FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | 硫酸亚铁溶液中加入用硫酸酸化的双氧水Fe2++2H++H2O2=Fe3++2H2O | |
| D. | 在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):HSO3-+Br2+H2O=3H++2Br-+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | Na2CO3 | NaClO | NaHCO3 | CH3COONa | NaHSO3 |
| pH | 11.6 | 10.3 | 9.7 | 8.8 | 5.2 |
| A. | 少量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO-=2H++Cl-+SO42- | |
| B. | 常温下,稀释CH3COOH或HClO溶液时,溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$不变(HR代表CH3COOH或HClO) | |
| C. | 等体积、等物质的量浓度的Na2CO3、CH3COONa、NaHSO3三种溶液混合,溶液中:c(HSO3-)>c(CH3COO-)>c(CO32-) | |
| D. | 含等物质的量的NaHCO3和CH3COONa的混合液中:c(OH-)-c(H+)=c(H2CO3)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铵盐是一种重要的水体污染物.某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理.
铵盐是一种重要的水体污染物.某课题组利用电解法,在含Cl-的水样中,探究将NH4+转化为N2而脱氮的影响因素和反应机理.| 实验方案 | 预期实验结果和结论 |
| 配制一定pH、NH4+和Cl-浓度的溶液,用最佳电流强度,电解样品90min后,采用电子自旋共振法检测样品中•OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 装置 |  | 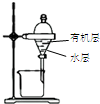 有机层水层 | 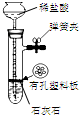 | 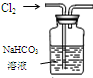 |
| 目的 | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 分离CCl4萃取碘水后已分层的有机层和水层 | 制取少量CO2气体 | 除去Cl2中含有的少量HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com