
| 猜想 | 实验设计 | 现象与结论 |
| 剩余气体为H2(或O2). | 将b中剩余气体通过灼热的氧化铜 (或将b中剩余气体通过灼热的铜网). | 若看到黑色固体变红(或红色固体变黑), 证明此猜想正确,反之则不正确. |
分析 (1)由于2CrO42-+2H+?Cr2O72-+H2O,则碱性条件下Cr3+被Na2O2氧化的产物为CrO42-,据此写出反应的离子方程式;
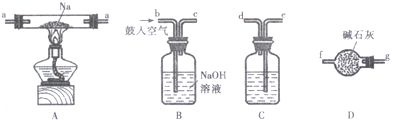
(2)I.①制备过氧化钠,需要先分别将空气中二氧化碳、水除去,还要防止空气中二氧化碳和水加入反应装置,据此连接装置;
②根据题干“将钠加热至熔化,通入一定量的除去CO2的空气,维持温度在453~473K之间,钠即被氧化为Na2O,进而增加空气流量并迅速提高温度至573~673K,可制得Na2O2”写出生成Na2O2的化学反应方程式;
③根据Na元素的守恒,2.3gNa反应后溶于1L水所得溶液中n(NaOH)=0.1 mol,据此计算出NH4Al(SO4)2溶液中n[NH4Al(SO4)2],然后写出反应的离子方程式;
II. ①将反应后固体溶于水后生成气体,且将气体导入密闭容器放电后气体体积减少3/5,说明气体由H2和O2组成;因为H2和O2分别为Na、Na2O2与水反应的产物,据此判断反应后固体组成;
②b中剩余气体可能为H2或O2,可分别用灼热的氧化铜或灼热的铜检验,现象分别为黑色固体变红或红色固体变黑,据此进行解答.
解答 解:(1)由于2CrO42-+2H+?Cr2O72-+H2O,碱性条件下Cr3+被Na2O2氧化的产物为CrO42-,该反应的离子方程式为:3Na2O2+2Cr3++4OH-=6Na++2CrO42-+2H2O,
故答案为:3Na2O2+2Cr3++4OH-=6Na++2CrO42-+2H2O;
(2)I.①由左至右分别为装置B(除去空气中的CO2)→装置C(除去气体中的H2O,防止其与Na反应)→装置A(制备Na2O2)→装置D(防止空气中的CO2和H2O进入A装置致使所得Na2O2变质),气体通过洗气瓶时从导气管长管进短管出,干燥管气体粗口进细口出,所以仪器接口顺序为:bcedaagf,
故答案为:bcedaagf;防止空气中的CO2和H2O进入A装置;
②根据题干“将钠加热至熔化,通入一定量的除去CO2的空气,维持温度在453~473K之间,钠即被氧化为Na2O;进而增加空气流量并迅速提高温度至573~673K,可制得Na2O2”可知生成Na2O2的化学反应方程式应为:2Na2O+O2═2Na2O2,
故答案为:2Na2O+O2═2Na2O2;
③有Na元素的守恒,2.3gNa反应后溶于1L水所得溶液中n(NaOH)=0.1 mol,所加NH4Al(SO4)2溶液中n(NH4Al(SO4)2)=0.025 mol,故反应的离子方程式为:NH4++Al3++4OH-=NH3•H2O+Al(OH)3↓,
故答案为:NH4++Al3++4OH-=NH3•H2O+Al(OH)3↓;
II. ①将反应后固体溶于水后生成气体,且将气体导入密闭容器放电后气体体积减少3/5,说明气体由H2和O2组成.因为H2和O2分别为Na、Na2O2与水反应的产物,所以反应后固体一定有Na、Na2O2,可能有Na2O,
故答案为:Na、Na2O2;
②b中剩余气体可能为H2或O2,可分别用灼热的氧化铜或灼热的铜检验,现象分别为黑色固体变红或红色固体变黑,即:
| 猜想 | 实验设计 | 现象与结论 |
| 剩余气体为H2 | 将b中剩余气体通过灼热的氧化铜 | 若看到黑色固体变红,证明此猜想正确,反之则不正确 |
| 猜想 | 实验设计 | 现象与结论 |
| 剩余气体为O2 | 将b中剩余气体通过灼热的铜网 | 若看到红色固体变黑,证明此猜想正确,反之则不正确 |
| 猜想 | 实验设计 | 现象与结论 |
| H2 | 将b中剩余气体通过灼热的氧化铜 | 黑色固体变红 |
| 猜想 | 实验设计 | 现象与结论 |
| O2 | 将b中剩余气体通过灼热的铜网 | 红色固体变黑 |
点评 本题通过制取过氧化钠的实验,考查了制备实验方案的设计,题目难度中等,明确实验目的和实验原理为解答关键,注意掌握钠及其化合物性质,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
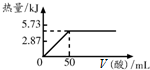 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,向50mL 2mol/L的NaOH溶液中加入1mol/L的某种酸恰好完全反应,测得加入酸的体积与反应放出热量的关系如下图所示(不考虑热量的散失),则该酸可能是( )
已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,向50mL 2mol/L的NaOH溶液中加入1mol/L的某种酸恰好完全反应,测得加入酸的体积与反应放出热量的关系如下图所示(不考虑热量的散失),则该酸可能是( )| A. | 醋酸(CH3COOH) | B. | 盐酸 | C. | 草酸(HOOC-COOH) | D. | 硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3F | B. | CCl4 | C. | COCl2 | D. | CH2ClCOOH. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂 | B. | 降低温度 | C. | 减小压强 | D. | 加入O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
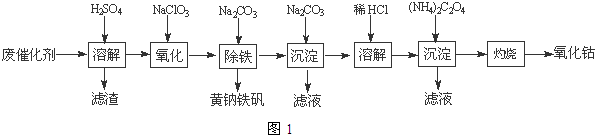
 (4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2•3Co(OH)2],沉淀需洗涤,洗涤的操作是向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次.
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)2•3Co(OH)2],沉淀需洗涤,洗涤的操作是向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出.重复操作2~3次.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn | B. | Cu | C. | Fe | D. | Mg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com