
| A. | 2.4g金属镁变为镁离子时所含电子数为NA | |
| B. | 1mol•L-1的A1Cl3溶液中,Cl-离子的数目为3NA | |
| C. | 标准状况下,22.4LSO3含有的分子数为NA | |
| D. | 常温常压下,16g O2和O3的混合气体所含分子数为NA |
分析 A.镁为2价金属,2.4g镁的物质的量为0.1mol,镁离子中含有10个电子;
B.没有告诉氯化铝溶液的体积,无法计算溶液中氯离子的物质的量及数目;
C.标准状况下,三氧化硫不是气体,不能使用标况下的气体摩尔体积计算其物质的量;
D.16个臭氧和氧气的混合物中含有16g氧原子,含有1mol氧原子,由于臭氧和氧气含有的原子数不同,无法确定混合物中的分子数.
解答 解:A.2.4g镁的物质的量为0.1mol,0.1mol镁离子中含有1mol电子,所含电子数为NA,故A错误;
B.没有告诉1mol•L-1的A1Cl3溶液的体积,无法计算溶液中氯离子的物质的量,故B错误;
C.标准状况下,三氧化硫的状态不是气体,题中条件无法计算22.4L SO3的物质的量,故C错误;
D.16g氧气和臭氧中含有16g氧原子,含有1mol氧原子,氧气和臭氧分别含有2个、3个O,二者含有的氧原子数目不同,无法确定化合物中含有的分子数目,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件;选项AD为易错点,注意A中需要计算的是镁离子含有的电子.


科目:高中化学 来源: 题型:选择题
| A. | 5项 | B. | 4项 | C. | 3项 | D. | 2项 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
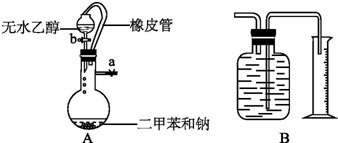
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
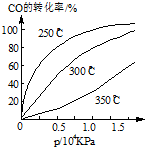 研究NO2、SO2.CO等大气污染气体的处理具有重要意义.
研究NO2、SO2.CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4溶于水的部分能够电离,所以BaSO4是电解质 | |
| B. | SO2的水溶液能够导电,所以SO2是电解质 | |
| C. | 液态Cl2不导电,所以Cl2是非电解质 | |
| D. | 盐酸能导电,所以盐酸是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
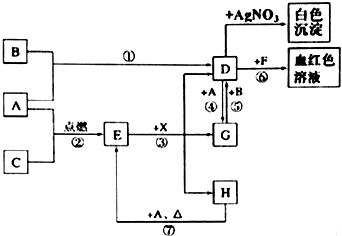
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | 澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
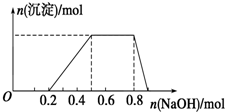 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关对该溶液的判断不正确的是( )
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列有关对该溶液的判断不正确的是( )| A. | 该溶液中肯定含有的离子是H+、NH4+、Al3+、SO42- | |
| B. | 肯定不含的阳离子是Mg2+、Fe3+ | |
| C. | 要确定该溶液是否含有Na+,必须做焰色反应实验,看焰色是否为黄色 | |
| D. | 该溶液中肯定含有的离子的物质的量之比为n(H+):n(NH4+):n(Al3+):n(SO42-)=2:3:1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓硝酸、浓硫酸均能将木炭氧化成二氧化碳 | |
| B. | Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱 | |
| C. | Li、C、S分别在足量氧气中燃烧均生成一种相应氧化物 | |
| D. | NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com