
| A. | 25℃时pH=10的NaOH溶液与pH=10的氨水中:c(Na+)>c(NH${\;}_{4}^{+}$) | |
| B. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) | |
| C. | 在NaHA溶液中(H2A为弱酸):c(Na+)>c(HA-)>c(OH-)>c(H+) | |
| D. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(OH-)=c(H+) |
分析 A.根据溶液中的电荷守恒判断;
B.混合液中醋酸的电离程度大于醋酸根离子的水解程度,则醋酸根离子浓度增大,则c(Na+)>c(CH3COOH),结合电荷守恒、物料守恒进行判断;
C.无法判断HA-的电离程度与水解程度大小,则无法判断溶液的酸碱性;
D.当硫酸氢铵与NaOH的物质的量为1:1时,反应生成等浓度的硫酸铵和硫酸钠,溶液显示酸性,若要为中性,则加入的氢氧化钠应该少过量,则c(Na+)>c(SO42-),结合电荷守恒进行判断各离子浓度大小.
解答 解:A.氨水与NaOH溶液的pH都是10,则两溶液中的氢离子、氢氧根离子浓度浓度相等,根据电荷守恒可知:c(CNa+)=c(NH4+),故A错误;
B.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO)>c(CH3COOH),根据物料守恒可得:c(Na+)>c(CH3COOH),结合电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+)可得:c(CH3COO-)+c(OH-)>c(H+)+c(CH3COOH),故B错误;
C.由于没有告诉HA-的水解程度与其电离程度大小,则无法判断溶液中氢离子和氢氧根离子浓度大小,故C错误;
D.NH4HSO4中滴加NaOH溶液,若二者物质的量相同时,溶质为等物质的量的(NH4)2SO4和Na2SO4,溶液呈酸性,需要再滴加少许NaOH呈中性,c(Na+)+c(NH4+)=2c(SO42-),故溶液中离子浓度大小关系为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故D正确;
故选D.
点评 本题考查离子浓度的大小比较,题目难度中等,注意把握弱电解质和盐类水解的特点,结合电荷守恒、物料守恒及盐的水解原理判断溶液中各离子浓度大小.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维、防弹玻璃、氧化铝陶瓷、硅藻土都是无机非金属材料,PLA、PE、橡胶、酚醛树脂都是人工合成高分子材料 | |
| B. | 贮氢金属并不是简单地吸附氢气,而是通过化学反应贮存氢气 | |
| C. | 科学家发现一种新的CO2晶体,该CO2晶体具有极强的硬度,是由CO2分子构成的空间立体网状结构 | |
| D. | 最新的氯碱工业是用离子交换膜电解槽电解饱和食盐水来生产氢气、氯气和烧碱的,电解槽中的离子交换膜既可以用阳离子交换膜也可以用阴离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲同学的方案可行 | |
| B. | 乙同学的方案可行 | |
| C. | 甲、乙两位同学的方案都有局限性 | |
| D. | 甲、乙两位同学的实验所涉及的卤代烃的性质一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
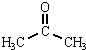 +CH3COOH
+CH3COOH
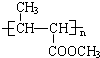 有一种合成这种高聚物的途径副产物污染少或无污染,原子利用率较高,符合“绿色化学挑战计划”的要求,其合成路线如下:
有一种合成这种高聚物的途径副产物污染少或无污染,原子利用率较高,符合“绿色化学挑战计划”的要求,其合成路线如下: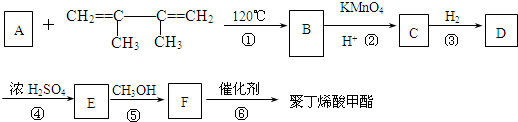
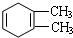 C:
C: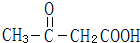
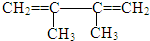 的系统命名名称是2,3-二甲基-1,3-丁二烯,反应⑥属于加聚反应(填反应类型)
的系统命名名称是2,3-二甲基-1,3-丁二烯,反应⑥属于加聚反应(填反应类型)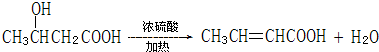 反应⑤:
反应⑤:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用加热分解法冶炼金属钾 | B. | 采用电解法冶炼金属铝和钠 | ||
| C. | 采用热还原法冶炼金属铁与汞 | D. | 采用热还原法冶炼金属铜与钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 丙烯分子中有8个σ键,1个π键 | |
| B. | 在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 | |
| C. | NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力 | |
| D. | NCl3和BC13分子中,中心原子都采用sp3杂化 | |
| E. | 在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78 gNa2O2晶体中所含阴阳离子个数均为2NA | |
| B. | 1.5 g CH3+中含有的电子数为NA | |
| C. | 3.4 g氨气分子中含有0.6NA个N-H键 | |
| D. | 常温下,100 mL1 mol•L-1AlCl3溶液中Al3+离子总数等于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com