
| A. |  过滤 | B. |  溶解 | C. |  蒸发 | D. |  焰色反应 |
分析 由草木灰提取钾盐并检验钾元素的步骤是溶解、过滤、蒸发,然后进行焰色反应,结合实验操作及仪器来解答.
解答 解:由草木灰提取钾盐并检验钾元素的步骤是溶解、过滤、蒸发,然后进行焰色反应.
A.溶解中用到玻璃棒,目的是加快溶解,故A正确;
B.过滤时除掉不溶性杂质,用玻璃棒来引流,故B正确;
C.蒸发结晶过程中也用到玻璃棒,目的是防止液体受热不均,液体外溅,故C正确;
D.焰色反应验证钾元素要要透过蓝色钴玻璃观察,紫色是钾焰色反应所呈现出的颜色,图中缺少蓝色钴玻璃,故D错误;
故选D.
点评 本题考查分离提纯的实验评价,为高频考点,把握混合物分离提纯、实验装置及实验技能为解答的关键,侧重分析与实验能力的考查,注意提纯步骤及对应装置,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol C4H10分子中共价键总数为13NA | |
| B. | 1L 1mol•L-1 盐酸中,含有HCl分子数为NA | |
| C. | 18g D2O 中含有的质子数和电子数均为10NA | |
| D. | 1molCl2与Fe 反应转移的电子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
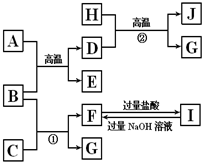 图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料.
图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
| A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
| B | 0.01 | c(Na+)>c(AlO2-)>c(OH-)>c(CO32-) |
| C | 0.015 | c(Na+)>c(HCO3-)>c(CO32-)>c(OH-) |
| D | 0.03 | c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Fe(OH)3(胶体)+3H+,生成的少量Fe(OH)3胶体可以吸附水中的悬浮杂质,达到净水的目的.
Fe(OH)3(胶体)+3H+,生成的少量Fe(OH)3胶体可以吸附水中的悬浮杂质,达到净水的目的.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

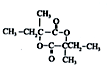 .
.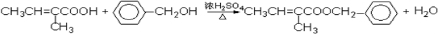 .
.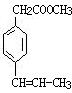 、
、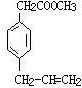 、
、 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com