
 .
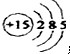
.分析 (1)P的原子序数为15,原子结构中有3个电子层,最外层电子数为5;
(2)P元素的化合价由+5价降低为0,以此计算转移电子;
(3)由2S2O32-+I2═S4O62-+2I-可知,维生素C消耗的碘为aV1×10-3mol-bV2×10-3mol×$\frac{1}{2}$,结合C6H8O6+I2═C6H6O6+2H++2I-计算维生素C的物质的量.
解答 解:(1)P的原子序数为15,原子结构中有3个电子层,最外层电子数为5,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)P元素的化合价由+5价降低为0,每生成1mol P4时,转移电子为1mol×4×(5-0)=20mol,故答案为:20;
(3)由2S2O32-+I2═S4O62-+2I-可知,维生素C消耗的碘为aV1×10-3mol-bV2×10-3mol×$\frac{1}{2}$,
由C6H8O6+I2═C6H6O6+2H++2I-可知维生素C与碘的物质的量相同,则维生素C的物质的量为$\frac{{a{V_1}-0.5b{V_2}}}{1000}$mol,
故答案为:$\frac{{a{V_1}-0.5b{V_2}}}{1000}$.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化及反应中物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 3v(H2)正=2v(NH3)逆 | B. | 容器内的总压强不再随时间而变化 | ||
| C. | N2、H2、NH3的分子数之比为1:3:2 | D. | 混合气体的密度不再随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因 | |
| B. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| C. | SO2具有漂白性,可用于漂白纸浆,也可以用于漂白食品 | |
| D. | 纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃由水电离的c(H+)=10-12mol/L 的溶液:Fe3+ Cl- NO3- K+ | |
| B. | 使酚酞变红的溶液:Na+ Cl- SO42-AlO2- | |
| C. | 某无色溶液:HCO3- NO3- Al3+ Ba2+ | |
| D. | 25℃时,pH=1的溶液:Ba2+ NO3- K+ I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.96L | B. | 4.48L | C. | 6.72L | D. | .3.36L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然皮革常用于制衣、制鞋、制胶,实际上它是凝固和变性的蛋白质 | |
| B. | 人体内不含水解纤维素的酶,故纤维素在人体内无任何作用 | |
| C. | 糯米中的淀粉一经水解,就酿成了酒 | |
| D. | 某品牌八宝粥不含糖类,糖尿病患者可放心食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,已知H2CO3?H++HCO3-K1=4.3×l0-7;
25℃时,已知H2CO3?H++HCO3-K1=4.3×l0-7;| A. | W点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) | |
| B. | pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 mol•L-1 | |
| C. | pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-) | |
| D. | pH=11的溶液中:CO32-+H2O?HCO3-+OH-K=1.8×l0-4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com