
 人胃酸过多会引起很多胃病.如图为某抗酸药包装标签上的部分文字,某同学欲检验该抗酸药有效成分是否是Al(OH)3,并测定该药片中氢氧化铝的含量是否达到标签标注的含量.请回答下列问题.
人胃酸过多会引起很多胃病.如图为某抗酸药包装标签上的部分文字,某同学欲检验该抗酸药有效成分是否是Al(OH)3,并测定该药片中氢氧化铝的含量是否达到标签标注的含量.请回答下列问题.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
| A、等体积的氢气和氧气所含的分子数相等 |
| B、氢分子与氧分子大小相同 |
| C、氢分子间的平均距离和氧分子间的平均距离几乎是相等的 |
| D、氢分子和氧分子本身的大小对于气体体积影响可以忽略不计 |
查看答案和解析>>
科目:高中化学 来源: 题型:
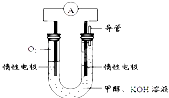 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素周期表第8、9、10三纵列合称Ⅷ族,Ⅷ族是元素周期表所有族中元素种类最多的族 |
| B、元素周期表中的所有副族元素都是金属元素,副族包含过渡元素和Ⅷ族 |
| C、在同一主族中,从上到下,F、Cl、Br、I的非金属性逐渐减弱 |
| D、因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方法步骤 | 现象 | 结论 |
| 取少量粉末加入足量稀硫酸 | 假设1成立 | |
| 假设2成立 | ||
| 假设3成立 |
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
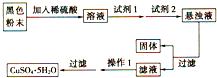 若经过实验分析确定,该黑色物质为氧化铜和氧化亚铁的混合物,实验小组欲利用该黑色粉末制取较纯净的硫酸铜,设计如图实验方案,则回答:试剂1是
若经过实验分析确定,该黑色物质为氧化铜和氧化亚铁的混合物,实验小组欲利用该黑色粉末制取较纯净的硫酸铜,设计如图实验方案,则回答:试剂1是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2O3加到热水中 |
| B、向NaAlO2溶液中加入过量盐酸 |
| C、将Na投入到NaAlO2溶液中 |
| D、在AlCl3溶液中滴几滴NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

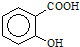 )可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式
)可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:2 | B、2:1 |
| C、1:2 | D、1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com