
����Ŀ����֪X��Y��Z��M��G��Q�����ֶ���������Ԫ�أ�ԭ��������������X��Z��Q�ĵ����ڳ����³���̬��Y��ԭ������������������Ӳ�����2����X��Mͬ���壻Z��G�ֱ��ǵؿ��к�����ߵķǽ���Ԫ�غͽ���Ԫ�أ� ��ش��������⣺
��1��Y��Z��M��G����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳���ǣ�дԪ�ط��ţ� ��
��2��Z��Ԫ�����ڱ��е�λ��Ϊ ��
��3������Ԫ�ص�����������Ӧ��ˮ����������ǿ���ǣ�д��ѧʽ�� ��
��4��X��Y���γɶ��ֻ�������мȺ����Լ��ֺ��Ǽ��Լ�������Է���������С�������ǣ�д����ʽ�� �� ��ʵ�����У���ȡ�����ʵķ�Ӧԭ���ǣ�д��ѧ����ʽ�� ��
��5��M2Z�ĵ���ʽΪ �� MX��ˮ��Ӧ�ɷų����壬�÷�Ӧ�Ļ�ѧ����ʽΪ ��
��6�������£�������G�ĵ��ʷ�����Ӧ���ǣ�����ţ� �� a��CuSO4��Һ b��Fe2O3 c��Ũ���� d��NaOH��Һ e��Na2CO3����
��ҵ���õ�ⷨ��G�ĵ��ʵĻ�ѧ����ʽ�� �� ����ʯīΪ�缫�����������Ļ������ijɷ��ǣ�д��ѧʽ�� ��
���𰸡�
��1��Na��Al��C��O
��2���ڶ����ڢ�A��
��3��HClO4
��4��C2H2��CaC2+2H2O��Ca��OH��2+C2H2��
��5��![]() ��NaH+H2O=NaOH+H2��
��NaH+H2O=NaOH+H2��
��6��be��2Al2O3�����ڣ� ![]() 4Al+3O2����O2��CO2��
4Al+3O2����O2��CO2��
���������⣺X��Y��Z��M��G��Q�����ֶ���������Ԫ�أ�ԭ��������������Z��G�ֱ��ǵؿ��к�����ߵķǽ���Ԫ�غͽ���Ԫ�أ���ZΪOԪ�ء�GΪAlԪ�أ�Y��ԭ������������������Ӳ�����2����ԭ������С��O��ֻ�ܴ��ڵڶ����ڣ�����������Ϊ4����YΪCԪ�أ�X�����ڳ����³���̬����XΪHԪ�أ�X��Mͬ���壬ԭ����������O����MΪNa��Q���ʳ�����Ϊ��̬��ԭ����������Al����QΪCl����1��ͬ�����������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶��С����ԭ�Ӱ뾶Na��Al��C��O�����Դ��ǣ�Na��Al��C��O����2��ZΪOԪ�أ���Ԫ�����ڱ��е�λ��Ϊ�ڶ����ڢ�A�壬���Դ��ǣ��ڶ����ڢ�A�壻��3������Ԫ�ص�����������Ӧ��ˮ����������ǿ����HClO4 �� ���Դ��ǣ�HClO4����4��H��C���γɶ��ֻ�������мȺ����Լ��ֺ��Ǽ��Լ�������Է���������С��������C2H2 �� ��ʵ�����У���ȡ�����ʵķ�Ӧԭ���ǣ�CaC2+2H2O��Ca��OH��2+C2H2�������Դ��ǣ�C2H2��CaC2+2H2O��Ca��OH��2+C2H2������5��Na2O�ĵ���ʽΪ ![]() ��NaH��ˮ��Ӧ�ɷų�����Ϊ������ͬʱ����NaOH���÷�Ӧ�Ļ�ѧ����ʽΪ NaH+H2O=NaOH+H2�������Դ��ǣ�
��NaH��ˮ��Ӧ�ɷų�����Ϊ������ͬʱ����NaOH���÷�Ӧ�Ļ�ѧ����ʽΪ NaH+H2O=NaOH+H2�������Դ��ǣ� ![]() ��NaH+H2O=NaOH+H2������6�������£�Al������ͭ��Һ��Ӧ�û�ͭ����Ũ���ᷴӦ�������ܵ������ﱣ��Ĥ�������ۻ�����������������Һ��Ӧ����ƫ����������������������������̼���Ʒ�Ӧ����ҵ���õ�ⷨ��Al�ĵ��ʵĻ�ѧ����ʽ��2Al2O3�����ڣ�
��NaH+H2O=NaOH+H2������6�������£�Al������ͭ��Һ��Ӧ�û�ͭ����Ũ���ᷴӦ�������ܵ������ﱣ��Ĥ�������ۻ�����������������Һ��Ӧ����ƫ����������������������������̼���Ʒ�Ӧ����ҵ���õ�ⷨ��Al�ĵ��ʵĻ�ѧ����ʽ��2Al2O3�����ڣ� ![]() 4Al+3O2��������ʯīΪ�缫������������������̼��Ӧ���ɶ�����̼��CO���������Ļ������ijɷ���O2��CO2�ȣ����Դ��ǣ�be��2Al2O3�����ڣ�
4Al+3O2��������ʯīΪ�缫������������������̼��Ӧ���ɶ�����̼��CO���������Ļ������ijɷ���O2��CO2�ȣ����Դ��ǣ�be��2Al2O3�����ڣ� ![]() 4Al+3O2����O2��CO2�ȣ�
4Al+3O2����O2��CO2�ȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽���ܴﵽʵ��Ŀ���ǣ� ��
A.�÷�Һ©����ʳ���з��������
B.����ɫ��Ӧ����Na2SO4��Na2CO3
C.��NaOH��Һ��ȥCl2�к��е�����HCl
D.��KSCN��Һ����FeCl3��Һ ���Ƿ���Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.�ں��������£���һ����X��Y�Ļ������ͨ��һ�ݻ�Ϊ2 L���ܱ������У�X��Y�����ʵ�Ũ����ʱ��仯�������ͼ��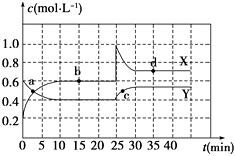
��1���÷�Ӧ�Ļ�ѧ����ʽΪ(��Ӧ����������÷���X��Y��ʾ)����
��2��0��10min��ѧ��Ӧ�ٶ�V��X��=��
��3���Ƚ�Y��0��10min��10��20minʱƽ����Ӧ���ʵĴ�С��v(0��10) v(10��20)�����������������=������ԭ������
��4��a��b��c��d�ĸ����У���ʾ��ѧ��Ӧ����ƽ��״̬�ĵ��� �� ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ȼ���ֲ���У���K1=5.4��10��2 �� K2=5.4��10��5 �� ��������κͼ���������ˮ���������������ˮ�����ᾧ�壨H2C2O42H2O����ɫ���۵�Ϊ101�棬������ˮ��������ˮ��������170�����Ϸֽ⣮��ش��������⣺ 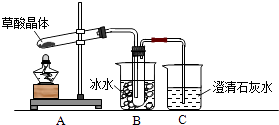
��1������ͬѧ����ͼ1��ʾװ�ã�ͨ��ʵ�������ᾧ��ķֽ���װ��C�пɹ۲쵽�������� �� �ɴ˿�֪���ᾧ��ֽ�IJ������� �� װ��B����Ҫ������ ��
��2������ͬѧ��Ϊ���ᾧ��ֽ�����л���CO��Ϊ������֤��ѡ�ü���ʵ���е�װ��A��B����ͼ��ʾ�IJ���װ�ã������ظ�ѡ�ã�����ʵ�飮 
�� ����ͬѧ��ʵ��װ���У��������ӵĺ���˳��ΪA��B�� �� װ��H��Ӧ����ʢ�е������� ��
����֤�����ᾧ��ֽ��������CO�������� ��
��3�����ʵ��֤���� �ٲ�������Ա�̼���ǿ ��
�ڲ���Ϊ��Ԫ�� ��
��4������Ͳ����ƣ�Na2C2O4�����������������±�KMnO4��Һ��MnO2��������Ԫ�ر���ԭΪ+2�ۣ�KMnO4��Һ�Ͳ�������Һ��ϡ�����з�Ӧ�����ӷ���ʽΪ�� �� ʵ���ҳ��ù�������ƲⶨKMnO4��Һ��Ũ�ȣ�ȷ��ȡ0.2000g�����ƣ�������ƿ�У�����100mLϡ�����ܽ⣬�����ƺõ�KMnO4��Һ�ζ��������ظ�ʵ������KMnO4��Һ������ֱ���16.02mL��16.00mL��16.01mL����KMnO4��Һ�����ʵ���Ũ�ȵļ���ʽ�ǣ�c��KMnO4��= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������0.05 mol��������������500 mLˮ�г�ֽ������Һ����������Ŀ������
A.NH4BrB.K2SO4C.Mg(OH)2D.Na2S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ������С��20��A��B��C��D��E��F6��Ԫ�أ����ǵ�ԭ����������������֪BԪ���ǵؿ��к�������Ԫ�أ�A��C�ļ۵�������ͬ��B��D�ļ۵�����Ҳ��ͬ����A��C��Ԫ��ԭ�Ӻ��������֮����B��D��Ԫ��ԭ�Ӻ���������֮�͵ģ�C��D��E����Ԫ�صĻ�̬ԭ�Ӿ�����ͬ�ĵ��Ӳ�������Eԭ�ӵ�p����ϵ�������Dԭ�ӵ�p����϶�һ�����ӣ�6��Ԫ�صĻ�̬ԭ���У�Fԭ�ӵĵ��Ӳ�������Һ�A����ͬһ���塣�ش���������:
��1���õ���ʽ��ʾC��E�γɻ�����Ĺ�����
��2��д����̬Fԭ�ӵĺ�������Ų�ʽ��
��3��д��A2D�ĵ���ʽ �� �������(���������������ͬ)������������
��4��A��B��C��ͬ�γɵĻ������л�ѧ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֶ�����Ԫ����ɵ�A��B��C��D��������ӣ�������18�����ӣ����Ƿ���������ԭ�ӵ���Ŀ����Ϊ2��3��4��6��A��C�����е�ԭ�Ӹ�����Ϊ1:1��B��D�����е�ԭ�Ӹ�����Ϊ1:2��D����Ϊ����ƽ�����ȼ�ϡ���ش��������⡣
��1��A��B��C��D���������ԭ�������ϴ������Ԫ�ص�һ�������ɴ�С���е�˳��Ϊ(��Ԫ�ط��Żش�)��
��2��A��HF��ȣ����ۡ��е�ϵͣ�ԭ������
��3��B���ӵ����幹��Ϊ�Σ��÷�����������(����ԡ��Ǽ��ԡ�)���ɴ˿���Ԥ��B������ˮ�е��ܽ�Ƚ�(����С��)��
��4��A��B�����ӵ�����ԭ�ӵ�����������Ӧ��ˮ���������ǿ��Ϊ(�ѧʽ)��
����A������ԭ��ΪX��B������ԭ��ΪY���Ƚ��������ʵ�����ǿ��(�>����<������)��
HXOHXO3HXO4��
H2YO3H2YO4��
��5��D��������ԭ�ӵ��ӻ���ʽ�� �� �ɸ�ԭ����ɵĵ��ʷ����а������м�����õ��ʷ��ӻ�Ϊ�ȵ�����ij������ӵķ���ʽΪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԻ�ѧ��Ӧ����ʶ��������ǣ� ��
A.������ѧ���ı仯
B.�����������
C.��Ȼ��������״̬�ı仯
D.��Ȼ�����������ı仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�10mL 0.40mol/L H2O2��Һ�������ֽ⣬��ͬʱ�̲������O2�������������Ϊ��״�������±���
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V��O2��/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
������������ȷ���ǣ���Һ����仯���Բ��ƣ��� ��
A.0��6 min��ƽ����Ӧ���ʣ�v��H2O2����3.3��10��2 mol/��Lmin��
B.6��10 min��ƽ����Ӧ���ʣ�v��H2O2����3.3��10��2 mol/��Lmin��
C.��Ӧ��6 minʱ��H2O2�ֽ���50%
D.��Ӧ��6 minʱ��c��H2O2��=0.30 mol/L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com