
����Ŀ��������450mL 0.5mol/LKOH��Һ���Իش��������⣺
��1��ѡ����������ɱ�ʵ���������������������ƽ����С������Ϊ1g����ҩ�ס��ձ��������������ȣ�
��2����������������ƽ���������KOH�������ձ��У���ҩƷ������ŷ�����������KOH������������ƫ��ƫС�����䡱����
��3���ܽ⡢��ȴ���ò�ʵ������Ҫʹ�ò��������������� ��
��4��ת�ơ�ϴ�ӣ���Һת�ƺ�Ҫϴ���ձ�2��3 �Σ���Ŀ���� ��
��5�����ݡ�ҡ�ȣ����ݵIJ����� ��
��6��ijͬѧʵ������KOH��Һ��Ũ��Ϊ0.48mol/L��ԭ�������������ĸ����
A.��������ʴ�������ⲻ����
B.����ƿ��ԭ��������������ˮ
C.ת��ʱ����Һ����
D.����ʱ���ӿ̶��ߣ�
���𰸡�
��1����ͷ�ιܣ�500mL����ƿ
��2������
��3������,�����ܽ�
��4����֤����ȫ��ת��������ƿ��
��5��������ƿ�м�������ˮ����̶���1��2cmʱ,���ý�ͷ�ιܵμ�����ˮ��Һ��İ�Һ��Ϳ̶�������
��6��CD
���������⣺��1������һ�����ʵ���Ũ����Һ�õ������У�������ƽ��ҩ�ס��ձ���������������ƿ����ͷ�ιܣ�����450mL 0.5mol/LKOH��Һ��Ӧѡ��500mL����ƿ�����Ի�ȱ�ٵ���������ͷ�ιܡ�500mL����ƿ��
���Դ��ǣ���ͷ�ιܡ�500mL����ƿ����2������450mL 0.5mol/LKOH��Һ��Ӧѡ��500mL����ƿ����Ҫ���ʵ�����m=0.5L��0.5mol/L��56g/mol=14.0g����С������Ϊ1g������Ҫʹ�����룬������ҩƷ������ŷ����������䣬
���Դ��ǣ����䣻��3���ܽ����ʱ��Ҫ�ò�����������ٹ����ܽ⣻
���Դ��ǣ����裬�����ܽ⣻��4������ʵ��ԭ��C= ![]() ��֪��Ϊ��֤ʵ��ɹ���Ӧ��֤�������ʾ�ת�Ƶ�����ƿ������ת�ơ�ϴ�ӣ���Һת�ƺ�Ҫϴ���ձ�2��3 �Σ���Ŀ���DZ�֤����ȫ��ת��������ƿ�У�
��֪��Ϊ��֤ʵ��ɹ���Ӧ��֤�������ʾ�ת�Ƶ�����ƿ������ת�ơ�ϴ�ӣ���Һת�ƺ�Ҫϴ���ձ�2��3 �Σ���Ŀ���DZ�֤����ȫ��ת��������ƿ�У�
���Դ��ǣ���֤����ȫ��ת��������ƿ�У���5�����ݵIJ�����������ƿ�м�������ˮ����̶���1��2cmʱ�����ý�ͷ�ιܵμ�����ˮ��Һ��İ�Һ��Ϳ̶������У�
���Դ��ǣ�������ƿ�м�������ˮ����̶���1��2cmʱ�����ý�ͷ�ιܵμ�����ˮ��Һ��İ�Һ��Ϳ̶������У���6��A����������ʴ�������ⲻ���䣬���³���������ƫ�࣬���ʵ����ʵ���ƫ����ҺŨ��ƫ�ߣ��ʲ�ѡ��
B������ƿ��ԭ��������������ˮ�������ʵ����ʵ�������Һ�����������Ӱ�죬��ҺŨ�Ȳ��䣬�ʲ�ѡ��
C��ת��ʱ����Һ���������²���������ģ����ʵ����ʵ���ƫС����Һ Ũ��ƫ�ͣ���Cѡ��
D������ʱ���ӿ̶��ߣ�������Һ���ƫ����ҺŨ��ƫ�ͣ���Dѡ��
��ѡ��CD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л�����ķ�Ӧ���ڼӳɷ�Ӧ����
A.����Һ�������屽
B.��ϩ���������Ҵ�
C.��֬ˮ����������
D.���Ҵ���������ŨH2SO4��ϼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����д�ʩ�����ڸ��Ʊ������������������ǣ� ��
A. ʹ��̫������ˮ�� B. �ƹ�ʹ�����ȼ�ϵĹ�����
C. ���շϵ�� D. ʹ�ò���������ϲ;�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ�����ֻ������ͷ�Ӧ�Ĺ�ϵ����ͼ��ʾ�������л�ѧ��Ӧ��������3���ǣ������� 
A.2H2+O2 ![]() 2H2O
2H2O
B.2NaHCO3 ![]() Na2CO3+H2O+CO2��
Na2CO3+H2O+CO2��
C.CuO+CO ![]() Cu+CO2
Cu+CO2
D.Zn+H2SO4=ZnSO4+H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������¼��㣺
��1��3.01��1023�������ӵ�����Ϊ�� ��
��2����״���£�L��������ԭ������98g����������ԭ������ͬ��
��3��2.4mol Cl2��Ԫ��R������ȫ��Ӧ����1.6mol RClx����xֵΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��������٤��������ֵ������˵����ȷ���ǣ�������
A.7.1g����������������������Һ��Ӧת�Ƶĵ�����Ϊ0.2��6.02��1023
B.50ml 12mol/L����������MnO2���ȣ�ת�Ƶĵ�����Ϊ0.3NA
C.0.1molNa2O2������������̼��ַ�Ӧת�Ƶĵ�����Ϊ0.2NA
D.0.1molFe��0.1mol������ȼ�գ�ת�Ƶĵ�����Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ӧ��������Ⱦ�����ƿ���������Ҫ�Ӷ�����֣�
��1���о����֣�NOx����������Ҫ�ɷ�֮һ��NOx��Ҫ��Դ������β����
��֪��N2��g��+O2��g��2NO��g����H=+180.50kJmol��1
2CO��g��+O2��g��2CO2��g����H=��566.00kJmol��1
Ϊ�˼��������Ⱦ���������������β�������ܿڲ��ô�����NO��COת��������Ⱦ����������ѭ����д���÷�Ӧ���Ȼ�ѧ����ʽ ��
��2���������������Դ�ɼ�����Ⱦ������������⣮�״���һ�ֿ������������Դ�����й����Ŀ�����Ӧ��ǰ����һ����������CO��H2�ϳ�CH3OH��CO��g��+2H2��g��CH3OH��g������2L�ܱ������г������ʵ���֮��Ϊ1��2��CO��H2 �� �ڴ��������³�ַ�Ӧ��ƽ��������CH3OH����������ڲ�ͬѹǿ�����¶ȵı仯��ͼ1��ʾ�� 
��i���÷�Ӧ�ķ�Ӧ�ȡ�H0���������������ѹǿ����Դ�С��P1P2���������������
��ii���÷�Ӧ��ѧƽ�ⳣ������ʽΪ ��
��iii�����и����У�����˵���÷�Ӧ�Ѿ��ﵽƽ����� ��
A������������ѹǿ���ٱ仯
B��v��CO����v��H2����v��CH3OH��=1��2��1
C�������ڵ��ܶȲ��ٱ仯
D�������ڻ�������ƽ����Է����������ٱ仯
E�������ڸ���ֵ������������ٱ仯
��iv��ij�¶��£��ڱ�֤H2Ũ�Ȳ��������£����������������ƽ��������ĸ����
A��������Ӧ�����ƶ� B�����淴Ӧ�����ƶ� C�����ƶ�
�������жϵ������� ��
��3������ȼ�շ�Ӧԭ�����ϳɵļ״����������ͼ2��ʾ��ȼ�ϵ��װ�ã�
��i�������缫��ӦʽΪ ��
��ii����ع���ʱ��������ǿ��ΪI��1��������������Ϊq��NAΪ����٤��������ֵ�����װ��ÿ�������ļ״������ʵ���Ϊmol�����軯ѧ��ȫ��ת��Ϊ���ܣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ȵ�����ˮ�У���ȴ��������кͣ����õ��ij�����( )
A.�Ȼ���
B.��֬������
C.��֬����
D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������[CO��NH2��2]��Na2CO3������Ҫ�Ļ���ԭ�ϺͲ�Ʒ����ͼ��ij�������������ɰ���������[CO��NH2��2]������IJ��ֹ�������ͼ�� 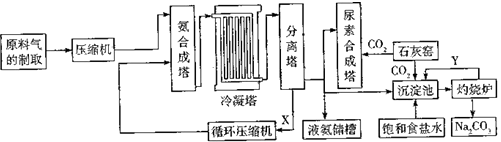
��1��ԭ��������ѹ����ǰ��Ҫ���о�����������Ŀ���� �� �Ʊ����ϳ����IJ�������ܡ����ܡ���ʹ����ͨ��̼�ظ֣�
��2��N2��H2������徭ѹ���������백�ϳ������ŵ��� �� ij����������ѭ��ʹ��ijЩԭ�Ͽ��������Ч�棬��ѭ�����õ������� ��
��3���밴Ҫ����д���пհף�
�ٳ������е����ӷ���ʽ�� ��
���������صĻ�ѧ����ʽ�� ��
��4���ڽϵ��¶��£��ɴӳ����ص���Һ�з����һ�ָ���Ʒ�ɴ˿��ƶϣ�������NH4C1���ܽ�Ⱥܿ������С�ڡ����ڡ���NaCL��NH4C1��һ�ֵ��ʣ�������ʩ����ʹ�����ữ�������ӷ���ʽ��ʾ��ԭ�� ��
��5���Խ�̿��ˮΪԭ���Ʊ�H2 ��̼ת��ΪCO2 �� ��1000g����Ϊa%�������ʲ���ˮ��Ӧ����̿�����Ʊ�g���أ���֪�ϳɰ�ʱh2��������Ϊb%���ϳ�����ʱNH3��������Ϊc%��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com