
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A、500s内N2O5分解速率为2.96×10-3 mol/(L?s) |
| B、T1温度下的平衡常数为K1=125,1000s时转化率为50% |
| C、其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 |
| D、T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若T1>T3,则K1>K3 |
| 消耗量 |
| 起始量 |
| 1.48mol/L |
| 500s |
| c(O2)c4(NO2) |
| c2(N2O5) |
| 1.25×54 |
| 2.52 |
| 5mol/L-2.5mol/L |
| 5mol/L |


科目:高中化学 来源: 题型:
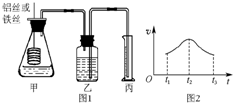 某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置.
某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn、Ag |
| B、Cu、Fe |
| C、Al、Fe |
| D、Mg、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2ClO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×105 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=1.8×10-11 |
| A、相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
| B、碳酸钠溶液中滴加少量氯水的离子方程式为CO2-3+Cl2+H2O=HCO-3+Cl-+HClO |
| C、向0.1mol?L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5 |
| D、向浓度均为1×10-3mol?L-1的KCl和K2CrO4混合液中滴加1×10-3mol?L-1的AgNO3溶液,CrO2-4先形成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
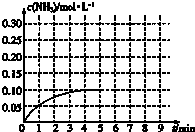 在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3溶液与稀氨水 |
| B、FeBr2溶液与Cl2 |
| C、CO2与Na2SiO3溶液 |
| D、澄清石灰水与Ca(HCO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
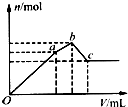 向100mL0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示.下列叙述正确的是( )
向100mL0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1Ba(OH)2溶液.随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示.下列叙述正确的是( )| A、a点的沉淀总物质的量为0.03mol |
| B、Oa段发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-═Al(OH)3↓+2BaSO4↓ |
| C、ab段发生反应的离子方程式是:2NH42++SO42-+Ba2++2OH-═2NH3?H2O+BaSO4↓ |
| D、反应到c点时,加入Ba(OH)2溶液的总体积为250mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com