
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5 表示。有关说法正确的是

A. 该装置为原电池,b为原电池的负极
B. 中间室Na+移向右室,Cl-移向左室,a极区溶液的pH减小
C. 当左室有4.48L(标准状况下)CO2生成时,右室产生的N2为0.8mol
D. b电极反应式:C6H10O5-24e-+7H2O===6CO2↑+24H+
【答案】B
【解析】
该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3-+10 e-+12H+=N2↑+6H2O,左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5-24e-+7H2O===6CO2↑+24H+。
A.该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,故A错误;
B.a是负极,中间室Na+移向右室,Cl-移向左室,电极反应式为C6H10O5-24e-+7H2O===6CO2↑+24H+,所以a极区溶液的pH减小,故B正确;
C.根据分析列关系式2N2~5CO2,n(N2)=![]() ×n(CO2)=
×n(CO2)=![]() ×
×![]() =0.08mol,故C错误;
=0.08mol,故C错误;
D.电极b是正极,电极反应式为2NO3-+10 e-+12H+=N2↑+6H2O,故D错误;
正确答案:B。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】在2A+B3C+4D中,表示该反应速率最快的是( )
A. v(A)=0.7molL﹣1S﹣1
B. v(B)=0.3 molL﹣1S﹣1
C. v(C)=0.8molL﹣1S﹣1
D. v(D)=1 molL﹣1S﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知3H2(g)+N2(g)![]() 2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=__。
(2)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。N![]() N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中__(填“吸收”或“放出”)的能量为__。
(3)为加快反应速率,可以采取的措施是__。
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离NH3
(4)CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2)。科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)![]() C(ads)+2H2(g)(慢反应)
C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)![]() 2CO(g)(快反应)
2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
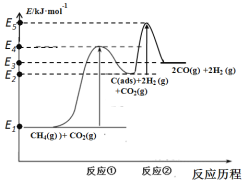
CH4与CO2制备“合成气”的热化学方程式为___。能量变化图中:E5+E1___E4+E2(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁香醛是常用的一种食用香精。存在下列转化关系:
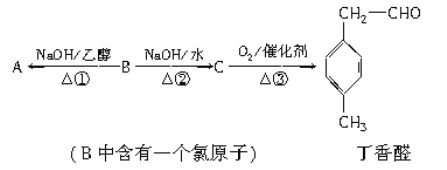
(1)B的分子式为________,C中含氧官能团的名称为________。
(2)反应②的化学方程式为____________________________________。
(3)A发生加聚反应所得产物的结构简式为________________。
(4)与A含有相同官能团的芳香族化合物的同分异构体还有________种(不考虑顺反异构),其中只有一个取代基且不含甲基的物质的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 常温下,10 mLpH=1的醋酸溶液中含有的氢离子数为0.001NA
B. 合成氨反应中,1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目等于NA
D. 常温常压下,18.4gNO2和N2O4的混合气体中含有的氮原子总数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向2L的密闭容器中投入一定量的X和Y,在催化剂的作用下发生反应:X(g) + Y(g)![]() Z(g)。反应过程中测定的部分数据如下表:
Z(g)。反应过程中测定的部分数据如下表:
t/min | n(X)/mol | n(Y)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
下列说法正确的是
A. 反应1~2min末的平均速率v(Z)=0.2mol/(L·min)
B. 在2min~4min间,v(X)正>v(Y)逆
C. 生成1mol Z的同时,生成1mol X能说明该反应已达化学平衡状态
D. 其他条件不变,再充入1.2mol X,X的转化率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。向该溶液中加入一定物质的量浓度的NaOH溶液时,生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是
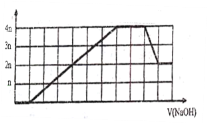
A. 原溶液中一定含有的阳离子是H+、NH4+、Mg2+、Al3+
B. 原溶液中一定含有SO42-和Na+
C. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D. 反应最后形成的溶液中含有的溶质仅为Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的NO(g) 是导致光化学烟雾和破坏臭氧层的重要源头之一。现拟用下列方法处理NO,根据题意回答下列问题:
(1)采用某种催化剂催化分解NO,发生反应2NO(g)![]() N2(g)+O2(g),在T1℃ 和T2℃时(T1>T2)NO的转化率随时间变化的结果如图所示。
N2(g)+O2(g),在T1℃ 和T2℃时(T1>T2)NO的转化率随时间变化的结果如图所示。
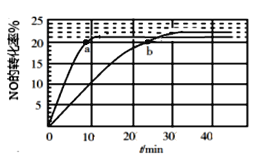
① 反应 2NO(g)![]() N2(g)+O2(g) 为(填“吸热”或“放热”)____________反应。
N2(g)+O2(g) 为(填“吸热”或“放热”)____________反应。
② T2℃时,反应的平衡常数K=__________(保留2位小数)。
③ 在T1℃下,要提高NO转化率,可采取的措施是_________________________
④ 比较a、b处反应速率大小:va(正)________ vb(逆)(填“大于”“小于”或“等于”)。已知反应速率 v正=k正x2(NO),v逆=k逆 x(N2)·x(O2),k正、k逆 分别为正、逆向反应速率常数,x为物质的量分数,计算b点处v(正)/v(逆)=__________(保留1位小数)。
(2)臭氧也可用于处理NO.O3氧化NO结合水洗可产生HNO3和O2,写出该反应的化学方程式___________________,每生成1mol的HNO3转移_______mol电子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用下图所示的装置设计实验,验证浓硫酸与木炭粉反应产生的各种产物。
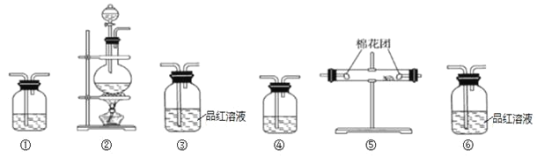
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是_______。
(2)实验装置的连接顺序(按产物气体从左至右的流向)是:_______→_______→③→④→_______→_______(填装置序号)。
(3)实验时可观察到装置③中溶液褪色,装置⑥中溶液不褪色,装置⑥的作用是_______。
(4)装置④中所盛溶液可能是_______(填选项字母)。
a.饱和Na2CO3溶液 b.饱和NaHCO3溶液 c.NaOH溶液 d.酸性KMnO4溶液
(5)装置⑤中所加的固体药品是_______(填化学式)。
(6)装置①中所盛溶液的溶质是_______(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com