
| A������̼�ᱵ��Ϊ�ڷ���Ӱ��������ΪKsp(BaCO3)��Ksp(BaSO4) |
| B�����ȱ������ж�����ʱ����û�������ƣ�������̼������Һ���� |
| C��������c(Ba2��)��1.0��10��5 mol/L����Һʱ�������������ж� |
| D��������0.36 mol/L��Na2SO4��Һ���������ж�����ϴθ |
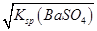 ��1.05��10��5 mol/L��1.0��10��5 mol/L��������c(Ba2��)��1.0��10��5 mol/L����Һʱ���������������ж���C������0.36 mol/L��Na2SO4��Һϴθʱ��θҺ��c(Ba2��)��Ksp(BaSO4)��c(SO42-)��(1.1��10��10��0.36) mol/L��3.1��10��10 mol/L��1.05��10��5 mol/L����D��ȷ��
��1.05��10��5 mol/L��1.0��10��5 mol/L��������c(Ba2��)��1.0��10��5 mol/L����Һʱ���������������ж���C������0.36 mol/L��Na2SO4��Һϴθʱ��θҺ��c(Ba2��)��Ksp(BaSO4)��c(SO42-)��(1.1��10��10��0.36) mol/L��3.1��10��10 mol/L��1.05��10��5 mol/L����D��ȷ��

 ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| A�����Ӻ�������ʹ���Ϊ��ͼװ�ã������װ�õ������ԡ� |
| B����ȡ��ϸ�Ļ�ͭ����Ʒ1.000g�� |
| C���������õ���ƷС�ĵط���Ӳ�ʲ������С� |
| D����ÿ����1L�����ʹ�������� |
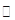 SO2 +2Cu��
SO2 +2Cu��
| �ζ� ���� | ������Һ�� ���/mL | ����Һ����� | |
| �ζ�ǰ�̶�/mL | �ζ���̶�/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
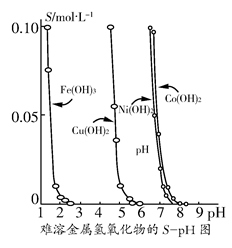
| ���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp(25 ��) | 8.0��10��16 | 2.2��10��20 | 4.0��10��38 |
| ��ȫ����ʱ��pHֵ | ��9.6 | ��6.4 | 3��4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��AgCl�������ɺ��ܽⲻ�Ͻ���,��������� |
| B��AgCl������ˮ,��Һ��û��Ag+��Cl- |
| C�������¶�,AgCl���ܽ�ȼ�С |
| D����AgCl�������ܽ�ƽ����ϵ�м���NaCl����,AgCl���ܽ�Ȳ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ܢۢڢ� | B���ڢۢܢ� | C���٢ܢۢ� | D���٢ۢڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ���� | FeS | MnS | CuS |
| Ksp | 6.3��10��18 | 2.5��10��13 | 1.3��10��35 |
| ���� | PbS | HgS | ZnS |
| Ksp | 3.4��10��28 | 6.4��10��33 | 1.6��10��24 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��CuS��Cu(OH)2��CuCO3 | B��CuCO3��Cu(OH)2����uS |
| C��CuS��CuCO3��Cu(OH)2 | D��Cu(OH)2����uCO3��CuS |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ͬŨ�ȵ�Na2SO4��Na2CO3�����Һ�еμ�BaCl2��Һ��BaSO4������ |
| B��BaCO3������Һ�м���������������ˮ��c(Ba2+)���� |
C��BaSO4��BaCO3���������Һ�У�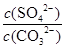 �� �� |
| D��BaSO4����Һ�м���Na2CO3Ũ��Һ��BaSO4������ת��ΪBaCO3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com