
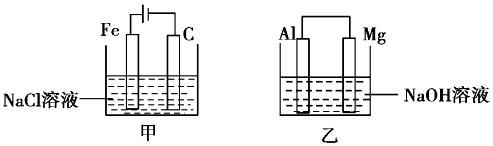
| A. | 甲装置中有沉淀生成,乙装置中Mg电极上有气泡生成 | |
| B. | 反应后,甲装置中溶液的质量增大,乙装置中溶液的质量减小 | |
| C. | 电极反应式:甲中阳极Fe-2e-=Fe2+,乙中负极Mg-2e-=Mg2+ | |
| D. | 反应后甲中溶液的pH减小,乙中溶液的pH增大 |
分析 甲为电解池,铁为阳极,发生氧化反应生成亚铁离子,C为阴极,发生还原反应生成氢气,乙为原电池,在氢氧化钠溶液中,铝为负极,发生氧化反应生成偏铝酸钠,镁为正极,发生还原反应生成氢气,以此解答该题.
解答 解:A.甲中亚铁离子被氧化,C极生成氢气和氢氧根离子,可生成氢氧化亚铁,乙中镁为正极,生成氢气,故A正确;
B.乙装置铝为负极,发生氧化反应生成偏铝酸钠,镁为正极,发生还原反应生成氢气,溶液质量增大,故B错误;
C.乙负极上电极反应式为Al+4OH--3e-=AlO2-+2H2O,故C错误;
D.甲生成氢氧化亚铁,pH增大,乙电池反应式为2Al+2NaOH+2H2O=3H2↑+2NaAlO2,pH减小,故D错误.
故选A.
点评 本题综合考查电解池、原电池原理,为高频考点,侧重考查学生的分析能力,正确判断原电池正负极是解本题关键,根据各个电极上发生的反应以及铝的化合物的性质来分析解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

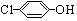 )的酸性废水;可利用微生物电池法除去,其原理如图2所示.
)的酸性废水;可利用微生物电池法除去,其原理如图2所示. -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

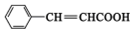 ,E中含有官能团的名称是羟基、羧基.
,E中含有官能团的名称是羟基、羧基.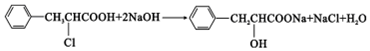 或
或 、2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
、2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.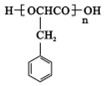 或
或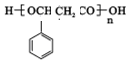 ,由E导H的反应类型为缩聚反应.
,由E导H的反应类型为缩聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净Cl2 | MnO2 | ① | ② |
| 制备纯净NO | Cu | ③ | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Cl-、Na+、SO42- | B. | MnO4-、K+、Cl-、Na+ | ||
| C. | NH4+、SO42-、OH-、Na+ | D. | CO32-、HCO3-、K+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物 | |
| B. | 某氧化物焰色反应为黄色,该氧化物为过氧化钠 | |
| C. | Na2O2中阴阳离子个数比1:l | |
| D. | 过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
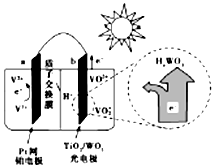
| A. | 光照时,b极的电极反应式为VO2+-e-+H2O═VO2++2H+ | |
| B. | 光照时,毎转移2mol电子,有2mol H+由a极区经质子交换膜向b极区迁移 | |
| C. | 夜间,a极的电极反应式为V3++e-═V2+ | |
| D. | 硅太阳能电池供电原理与该电池相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com