
【题目】水煤气(CO和H2)是合成甲醇的重要原料,它可用水蒸气通过炽热的炭层制得:C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
(1)该反应的平衡常数的表达式为_________________;升高温度,K值将________;容器中气体的平均相对分子质量将________。(填“增大”、“减小”或“不变”)。
(2)上述反应达到平衡后,将体系中的C(s)部分移走,平衡将________(填字母)。
A.向左移 B.向右移 C.不移动
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有________(填字母)。
A.单位体积内每消耗1 mol CO的同时生成1 mol H2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
(4)某温度下,将4.0 mol H2O(g)和足量的炭充入2 L的密闭容器中,发生如下反应,C(s)+H2O(g)![]() CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为________。
CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为________。
【答案】K=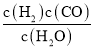 增大 减小 C AB 50%
增大 减小 C AB 50%
【解析】
(1)根据化学平衡常数的概念以及温度对化学平衡、化学平衡常数的影响分析;
(2)固体的浓度为常数,平衡不移动;
(3)依据平衡标志是正逆反应速率相同,各组分含量保持不变,结合反应特征和平衡移动原理分析选项;
(4)依据化学平衡三段式列式计算,转化率=![]() ×100%计算得到。
×100%计算得到。
(1)根据化学平衡常数为平衡时生成物浓度幂之积比反应物浓度幂之积,反应C(s)+H2O(g)![]() CO(g)+H2(g)的平衡常数的表达式为K=
CO(g)+H2(g)的平衡常数的表达式为K=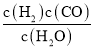 ;化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,反应C(s)+H2O(g)
;化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,反应C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ·mol-1为吸热反应,升高温度,平衡正向移动,化学平衡常数增大;如果反应物完全转化为生成物,则容器中气体的平均相对分子质量是(28+2)/2=15,由于升高温度平衡向正反应方向进行,所以容器中气体的平均相对分子质量将减小。
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1为吸热反应,升高温度,平衡正向移动,化学平衡常数增大;如果反应物完全转化为生成物,则容器中气体的平均相对分子质量是(28+2)/2=15,由于升高温度平衡向正反应方向进行,所以容器中气体的平均相对分子质量将减小。
(2)上述反应达到平衡后,将体系中的C(s)部分移走,浓度不变,平衡不移动;
答案选C;
(3)A.单位体积内每消耗1mol CO的同时生成1molH2,说明一氧化碳或氢气正逆反应速率相同,反应达到平衡状态,选项A正确;
B.反应前后气体物质的量变化,混合气体总物质的量保持不变说明反应达到平衡状态,选项B正确;
C.生成H2O(g)的速率与消耗CO的速率相等只能说明反应逆向进行,不能说明反应达到平衡状态,选项C错误;
D.H2O(g)、CO、H2的浓度相等和起始量变化量有关,不能作为平衡标志,选项D错误;
答案选AB;
(4)设H2O转化了xmol/L,依据化学平衡三段式列式计算:
C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
初始浓度(mol/L) 2.0 0 0
转化浓度(mol/L) x x x
平衡浓度(mol/L) 2.0-x x x
达到平衡时测得K=1,即K=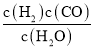 =
=![]() =1,解得x=1mol/L,所以α(H2O)=
=1,解得x=1mol/L,所以α(H2O)=![]() ×100%=50%。
×100%=50%。


科目:高中化学 来源: 题型:
【题目】T℃时,在1 L的密闭容器中充入2 mol CO2和6mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得H2和CH3OH(g)的浓度随时间变化如右图所示。下列说法不正确的是 ( )
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,测得H2和CH3OH(g)的浓度随时间变化如右图所示。下列说法不正确的是 ( )
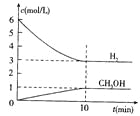
A.0~10min内v(H2)=0.3mol/(L·min)
B.T℃时,平衡常数K=![]() ,CO2和H2的转化率相等
,CO2和H2的转化率相等
C.T℃时,上述反应中有64g CH3OH生成,同时放出98.0kJ的热量
D.达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2 是一种重要的杀菌消毒剂,也常用来漂白织物等,一种生产NaClO2 的工艺如下:
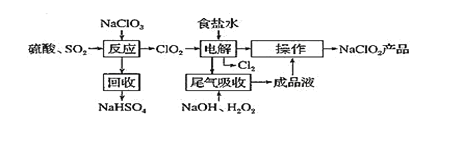
已知:①ClO2是一种强氧化性气体,浓度大时易分解爆炸。在生产使用时要用稀有气体或空气等进行稀释,同时避免光照、震动等。②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·33H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。回答下列问题:
(1)最近科学家又在“反应”步骤的基础上研究出用H2C2O4代替SO2制备ClO2的新方法,该方法的化学方程式为______________________。
(2)获得产品NaClO2的“操作”包括以下步骤:
①减压,55℃蒸发结晶;②趁热过滤;③___________________________④低于60℃干燥,得到产品。
(3)为了测定产品NaClO2的纯度,取上述所得产品12.5g溶于水配成1L溶液,取出10.00mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(ClO2-被还原为Cl-杂质不参加反应),加入2~3滴淀粉溶液,用0.25molL﹣1Na2S2O3标准液滴定,达到滴定终点时用去标准液20.00mL,试计算产品NaClO2的纯度_________________________(提示:2Na2S2O3+I2=Na2S4O6+2NaI)

(4)NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒。经测定 25℃各含氯微粒浓度随 pH 的变化情况如图所示(Cl-没有画出)
①酸性条件下NaClO2溶液中存在Cl-的原因是_______________________(用离子方程式解释)。
②pH=5时,NaClO2溶液中ClO2、HClO2、ClO2-、Cl-四种含氯微粒的浓度由大到小的顺序是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为二元弱酸,
为二元弱酸,![]() ,
,![]() ,设
,设![]() 溶液中
溶液中![]() 。室温下用NaOH溶液滴定
。室温下用NaOH溶液滴定![]() 溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.![]() 溶液:
溶液:![]()
B.![]() 的溶液:
的溶液:![]()
C.![]() 的溶液:
的溶液:![]()
D.![]() 的溶液:
的溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洗煤和选煤过程中排出的煤矸石(主要含Al2O3、SiO2及Fe2O3)会占用大片土地,造成环境污染。某课题组利用煤矸石制备聚合氯化铝流程如下:
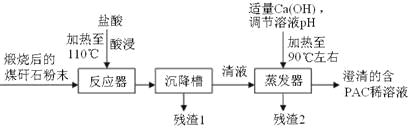
已知:聚合氯化铝([Al2(OH)nCl6-n]m(1≤n≤5,m≤10),商业代号PAC)是一种新型、高效絮凝剂和净水剂。
(1)酸浸的目的是___________________________;实验需要的500mL3.0 mol·L-1的盐酸,配制时所需要的玻璃仪器除量筒、烧杯、玻璃棒外还有______________________。
(2)若m=n=2,则生成PAC的化学方程式是_____________________。
(3)从含PAC的稀溶液中获得PAC固体的实验操作方法是_______、_________、_________。
(4)为了分析残渣2中铁元素的含量,某同学称取5.000g残渣2,先将其预处理使铁元素还原为Fe2+,并在容量瓶中配制成100mL溶液;然后移取25.00mL试样溶液,用1.000×10-2mol·L-1KMnO4标准溶液滴定,消耗标准溶液20.00mL。已知反应式为Fe2++MnO4-+H+—Fe3++Mn2++H2O(未配平)。判断滴定终点的依据是_______________________;残渣2中铁元素的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水含有![]() 和
和![]() 等离子,需经污水处理达标后才能排放,污水处理拟用如图流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理拟用如图流程进行处理:
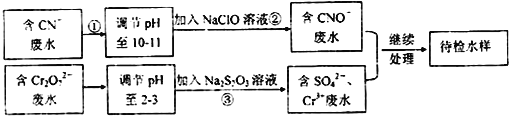
回答下列问题:
![]() 步骤
步骤![]() 中,
中,![]() 被
被![]() 氧化为
氧化为![]() 的离子方程式为 ______ .
的离子方程式为 ______ .
![]() 步骤
步骤![]() 的反应方程式为
的反应方程式为![]() 未配平
未配平![]() ,则每消耗
,则每消耗![]()
![]() ,反应中
,反应中![]() 失去
失去![]() ______ mo1.
______ mo1.
![]() 含
含![]() 废水可以加入熟石灰进一步处理,目的是 ______ .
废水可以加入熟石灰进一步处理,目的是 ______ .
![]() 在
在![]() 下,将a
下,将a![]() 的NaCN溶液与
的NaCN溶液与![]() 的盐酸等体积混合,反应后测得溶液
的盐酸等体积混合,反应后测得溶液![]() ,用含a的代数式表示
,用含a的代数式表示![]() 的水解常数
的水解常数![]() ______
______ ![]() 若
若![]() 时将浓度均为
时将浓度均为![]() 的NaCN、HCN溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是 ______
的NaCN、HCN溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是 ______ ![]() 填字母
填字母![]() .
.
![]() 此溶液一定有
此溶液一定有![]()
![]() 此溶液一定有
此溶液一定有![]()
C 混合溶液中水的电离程度一定大于该温度下纯水的电离程度
![]() 此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
![]() 利用
利用![]() 通过下列方法测定某锡粉的纯度
通过下列方法测定某锡粉的纯度![]() 杂质不参与反应
杂质不参与反应![]() :取ag锡粉溶于盐酸中,向生成的
:取ag锡粉溶于盐酸中,向生成的![]() 中加入过量的
中加入过量的![]() 溶液,用b
溶液,用b![]()
![]() 滴定生成的
滴定生成的![]() 已知酸性环境下,
已知酸性环境下,![]() 可被还原为
可被还原为![]() ,共用去
,共用去![]() 溶液m
溶液m![]() 则锡粉中锡的质量分数是 ______
则锡粉中锡的质量分数是 ______ ![]() 的摩尔质量为M
的摩尔质量为M![]() ,用含a、b、m、M的代数式表示
,用含a、b、m、M的代数式表示![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 向淀粉的酸性水解液中滴入少量新制Cu(OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
B | NaAlO2溶液与NaHCO3溶液混合 | 白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 的△H<0 |
D | 向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1mol/L的NaI溶液,再振荡 | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)sp(AgCl) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列体系中,离子可能大量共存的是![]()
A.滴加KSCN显红色的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
B.常温下,水电离出的![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
C.使酚酞试剂显红色的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
D.加入Al能产生![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将![]() 、NO、
、NO、![]() 混合并充满容器,然后把容器倒置于水槽中,充分反应后,水充满容器,则容器内
混合并充满容器,然后把容器倒置于水槽中,充分反应后,水充满容器,则容器内![]() 的物质的量浓度的大小范围是( )
的物质的量浓度的大小范围是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com