
如图为相互串联的甲、乙两电解池。试回答:
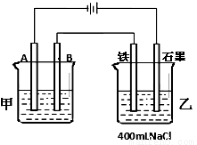
(1)若甲电解池利用电解原理在铁上镀铜,则A是 、 (填电极材料和电极名称),电极反应是 ;B是(要求同A) 、 ,电极反应是 ,应选用的电解质溶液是 ;乙电解池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈 色。
(2)若甲电解池阴极增重1.28g,乙电解池中剩余溶液仍为400mL,则电解后所得溶液中新生成溶质的物质的量浓度为 mol/L,溶液的pH等于 。
(3)若甲电解池以I=0.21A的电流电解60min后阴极增重0.25g,则此实验测得的阿伏加德罗常数NA为多少(已知电子电量e—=1.60×10—19C)?(简要写计算过程)
(1)(各1分)铁; 阴极; Cu2++2e-=Cu;铜;阳极;Cu2+—2e-=Cu2+ 含Cu2+的溶液(或可溶性铜盐皆可);红;
(2)(各2分)0.1; 13
(3)(2分,等式或算式和结果各1分)根据电量守恒,电路中通过的物理电量等于电解时发生氧化还原反应中两极上转移的电子的化学电量。所以有:
Q=It=2×NA×1.60×10—19 C×0.25g/64g·mol—1
It=0.21A×60×60s
NA =6.05×1023mol—1
【解析】
试题分析:⑴电镀利用的是电解的原理,电镀池中,阳极是镀层金属,阴极是镀件,电解质是含有镀层金属离子的盐溶液。
⑵若电解池甲中阴极增重1.28g,则表明有0.02mol的铜溶解。在电路中转移0.04mol的电子,同样在乙池中也转移0.04mol的电子,那么此时生成的氢氧化钠为0.04mol,因此其浓度为:0.1mol/L。那么溶液中的氢离子浓度就为 ,所以其pH=13。
,所以其pH=13。
⑶根据电量守恒,电路中通过的物理电量等于电解时发生氧化还原反应中两极上转移的电子的化学电量。所以有:
Q=It=2×NA×1.60×10—19 C×0.25g/64g·mol—1
It=0.21A×60×60s
NA =6.05×1023mol—1
考点:考查电解的有关知识。


科目:高中化学 来源:2015届福建省四地六校高二下学期第一次月考化学试卷(解析版) 题型:选择题
核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知质子数或中子数为奇数的原子核才有NMR现象,而质子数和中子数均为偶数的原子不产生核核磁共振,下列原子组一定能产生NMR现象的是( )
A.18O、31 P、119 Sn B.27 Al、19 F、12 C
C.6C、16S、9F D.1 H、13 C、35 Cl
查看答案和解析>>
科目:高中化学 来源:2015届湖北省黄石市高二上学期期末考试化学试卷(解析版) 题型:选择题
对于可逆反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,降低温度产生的影响为
2SO3(g) ΔH<0,降低温度产生的影响为
A.v正 增大,v逆减小 B.v正减小,v逆增大
C.v正和v逆同程度的减小 D.v正和v逆不同等程度的减小
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:选择题
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸
氧腐蚀相同。下列分析正确的是
A.含有 1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
B.脱氧过程是吸热反应,可降低温度,延长糕点保质期
C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH-
D.脱氧过程中铁作原电池正极,电极反应为:Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③2.0molPCl3和1.0molCl2充入恒容的密闭容器中,发生反应:PCl3(g)+ Cl2(g) PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol
PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡不会发生移动
A.①④ B.①②③ C.②③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末质量检测化学试卷(解析版) 题型:选择题
中国人民银行定于2011年4月15日发行中国京剧脸谱彩色金银纪念币,其中银纪念币材料为铜芯镀银,依据你所掌握的电镀原理,你认为银纪念币制作时,铜芯应做
A.阴极 B.阳极 C.正极 D.负极
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末质量检测化学试卷(解析版) 题型:选择题
汽车等机动车辆的启动电源常用铅蓄电池,放电时的电池反应如下:
PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
A.PbO2是电池的负极
B.负极的电极反应式为:Pb+SO42--2e-=PbSO4
C.PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末考试化学试卷(解析版) 题型:选择题
中国人民银行定于2011年4月15日发行中国京剧脸谱彩色金银纪念币,其中银纪念币材料为铜芯镀银,依据你所掌握的电镀原理,你认为银纪念币制作时,铜芯应做
A.阴极B.阳极C.正极D.负极
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:填空题
工业上制备H2的一种重要方法是: CO(g) + H2O(g)  CO2 (g) + H2(g) △H=Q kJ/mol 。已知该反应的平衡常数K与温度T的关系如图所示。若在一固定的密闭容器中, 850℃ 时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:
CO2 (g) + H2(g) △H=Q kJ/mol 。已知该反应的平衡常数K与温度T的关系如图所示。若在一固定的密闭容器中, 850℃ 时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:
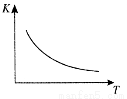
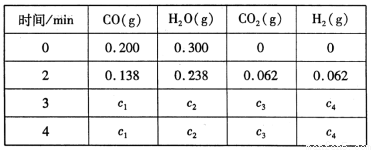
已知:850℃ 时该反应的化学平衡常数K =1.0 ,请回答下列问题:
(1)Q 0(填“ > ”、“ = ”或“<” )。
(2)可以判断该反应达到化学平衡状态的叙述是 (填字母)。
A.单位时间内减少 CO(g)的浓度等于生成 CO2 (g)的浓度
B.反应容器内的压强不发生变化
C.混合气体中 H2 (g)的浓度不再发生改变
D.氢气的生成速率等于水的生成速率
(3)若在850 ℃时向反应容器中充人H2O(g) , K 值 (填“增大”、“减小”或“不变”)。
(4)上表中 c2为 mol/L , CO(g)的转化率为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com