
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G 为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。其转化关系如图。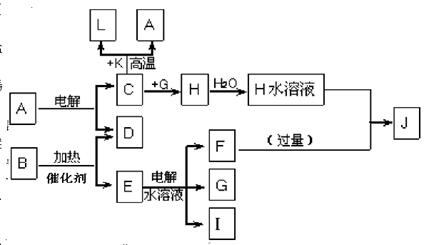
请回答:
(1)工业上制C用A不用H的原因
(2)写出C与K反应的化学方程式 ,该反应的反应物总能量 (填“大于”或“小于”)生成物总能量
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式 ,电解后为使溶液与电解前完全相同,需向上述溶液中通入
(4)J与H反应的离子方程式为
(9分)
(1)氯化铝是共价化合物,熔融状态下不导电(合理即可)(1分)
(2)2Al+Fe2O3 Al2O3+2Fe (2分) 大于(1分)
Al2O3+2Fe (2分) 大于(1分)
(3)2KCl+2H2O  2KOH+H2↑+Cl2↑(2分) 氯化氢或HCl(1分)
2KOH+H2↑+Cl2↑(2分) 氯化氢或HCl(1分)
(4)Al3++3AlO2-+6H2O=4Al(OH)3↓ (2分)
解析试题分析:由题意可知,G为Cl2,D为O2,K为Fe2O3,B中含有钾离子,结合转化关系图,可推知B是KClO3,常用于制备氧气,E是KCl,I是H2,F是KOH;H含有氯元素,又能与过量的碱反应,生成H的C可以和Fe2O3高温下反应,可知H是AlCl3,而J是KAlO2,C是Al,A是Al2O3,L是Fe。(1)氯化铝是共价化合物,熔融状态下不导电,故用氧化铝;(2)即铝和氧化铁的反应,该反应能放出大量的热,反应物总能量高于生成物总能量;(3)电解KCl的水溶液,该电解过程,氢离子得电子被还原成氢气,氯离子失电子被氧化成氯气,溶液中实际减少的物质含氢元素和氯元素;(4)铝离子和偏铝酸根离子发生双水解,生成氢氧化铝沉淀。
考点:短周期元素的互相转化;常见金属及其重要化合物
点评:本题考查短周期元素的互相转化及常见金属及其重要化合物的相关知识,综合性较强,有一定难度,解答此类题目应熟悉各种物质的性质及反应的条件,根据已知条件,逐步推断未知物质及未知的反应。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省西安市高三第四次质量检测化学试卷(解析版) 题型:填空题
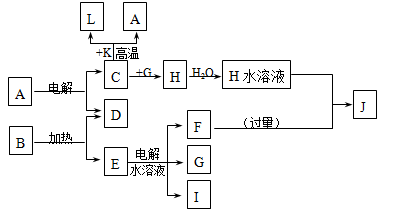
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。其转化关系如图。
请回答:
(1)工业上制C用A不用H的原因
(2)写出C与K反应的化学方程式 ,该反应的反应物总能量 (填“大于”或“小于”)生成物总能量
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式 。
(4)J与H反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年海南省琼海市高三下学期第一次月考化学试卷(解析版) 题型:推断题
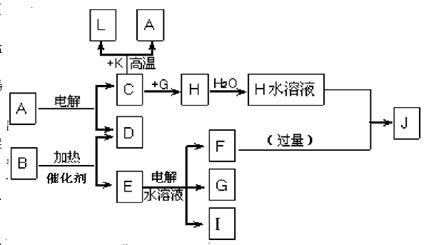
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G 为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。其转化关系如图。
请回答:
(1)工业上制C用A不用H的原因
(2)写出C与K反应的化学方程式 ,该反应的反应物总能量 (填“大于”或“小于”)生成物总能量
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式 ,电解后为使溶液与电解前完全相同,需向上述溶液中通入
(4)J与H反应的离子方程式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com