
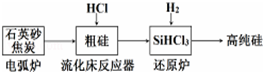
| 发生的主要反应 | |
| 电弧炉 | SiO2+2C$\frac{\underline{\;1600-1800℃\;}}{\;}$si+2CO |
| 流化床反应器 | Si+3HCl$\frac{\underline{\;250-300\;}}{\;}$SiHCl3+H2 |
| 还原炉 |
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/°C | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
分析 (1)石英砂主要成分为二氧化硅,粗硅提纯是利用碳做还原剂还原二氧化硅为单质硅,二氧化硅和碳在高温的条件下反应生成碳化硅和一氧化碳,还原炉中SiHCl3和氢气发生反应生成硅和氯化氢;
①还原炉中SiHCl3和氢气发生反应生成硅和氯化氢;可循环使用的物质是参与反应过程,最后又从新生成的物质;石英砂主要成分为二氧化硅,粗硅提纯是利用碳做还原剂还原二氧化硅为单质硅,二氧化硅和碳在高温的条件下反应生成碳化硅和一氧化碳;
②根据题中数据,采用精馏(或蒸馏)方法提纯SiHCl3;
③SiHCl3水解生成硅酸、氢气和氯化氢;
(2)①由SiCl4和NH3反应制取Si3N4,根据反应物和生成物写出化学方程式;
②化学气相沉积法是两种或两种以上的气态原材料导入到一个反应室内,然后他们相互之间发生化学反应,形成一种新的材料,沉积到晶片表面上得较高纯度的氮化硅,根据反应物和生成物写出化学方程式;
③Si3N4与MgO反应除生成Mg3N2外还可能生成SiO2,SiO2与盐酸不反应,而Mg3N2、MgO溶于盐酸的性质.
解答 解:(1)①还原炉中SiHCl3和氢气发生反应制得纯硅,SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl,流程分析可知可循环使用的物质为HCl和H2;用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,石英砂的主要成分是二氧化硅,制备粗硅发生置换反应,SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,同时,在反应中,也可能生成碳化硅,反应为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑,
故答案为:SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;HCl和H2;SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑;
②利用沸点的不同提纯SiHCl3属于蒸馏,SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),由于沸点差别较大,可以通过精馏(或蒸馏)除去杂质;
故答案为:精馏(或蒸馏);
③SiHCl3水解反应生成硅酸、氢气和氯化氢,反应的方程式为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑,故答案为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑;
(2)①SiCl4和NH3反应生成Si3N4和氯化氢,反应化学反应方程式:3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl,故答案为:3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl;
②SiCl4与N2、H2反应生成Si3N4,还应生成HCl,化学方程式为:3SiCl4+2N2+6H2 $\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl,故答案为:3SiCl4+2N2+6H2 $\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl;
③由元素守恒判断,Si3N4与MgO反应除生成Mg3N2外还可能生成SiO2,利用SiO2与盐酸不反应,而Mg3N2、MgO溶于盐酸的性质,可采用加入足量稀盐酸的方法,使MgO、Mg3N2溶解后过滤;
故答案为:SiO2;加足量稀盐酸过滤.
点评 本题考查了实验方案设计的有关知识,侧重考查了硅及其化合物的有关知识,注意粗硅的提纯反应原理,注意根据质量守恒书写化学方程式,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 石英坩埚耐高温,可用来加热熔融氢氧化钠固体 | |
| B. | 聚氯乙烯塑料在日常生活中可用来进行食品包装 | |
| C. | 硫酸亚铁溶液和水玻璃在空气中久置后均变质 | |
| D. | 甲醛可用作食品防腐剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| 1 | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| 2 | Cl2、FeBr2 | FeCl3、FeBr3 |
| 3 | MnO4-、Cl-… | Cl2、Mn2+… |
| A. | 第①组反应的其余产物为H20 | |
| B. | 第②组反应中CI2与FeBr2的物质的量之比小于或等于1:2 | |
| C. | 第③组反应中生成1mol Cl2,转移电子5 mol | |
| D. | 氧化性由强到弱顺序为Mn04->Cl2>Fe3+>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCl2完全溶于水时转移的电子数为NA | |
| B. | 1mol羟基(-OH)含有的电子数为9NA | |
| C. | 100g30%醋酸溶液中氢原子数为2NA | |
| D. | 100mL水中OH-的个数是10-8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Al3+、SO42-、NO3- | B. | Mg2+、K+、Cl-、NO3- | ||
| C. | HCO3-、K+、Cu2+、SO42- | D. | K+、Na+、OH-、Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是丁达尔现象 | |
| B. | 将饱和FeCl3溶液逐滴加入NaOH溶液中可制备Fe(OH)3胶体 | |
| C. | Al(OH)3胶体能使水中的悬浮颗粒沉降,达到净水的目的 | |
| D. | 豆浆、蔗糖溶液均属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO (g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO (g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com